苹果黑星病是由苹果黑星菌Venruria inaequalis侵染引起的苹果上的重要病害,发病严重时通常造成叶片畸形脱落,果面形成黑色疮痂,病果率可达70%以上(Machardy 1996)。该病害自从上世纪20年代在我国河北首次发现后,60年代在新疆伊犁河谷有发生报道,90年代在陕西、甘肃、新疆等部分苹果主产区呈严重发生危害。目前,该病害在陕西、山东、甘肃、河北、河南、新疆、辽宁、吉林、黑龙江、四川、云南等12个省区均呈扩展蔓延趋势(商鸿生 2006)。苹果黑星病在我国部分省区持续发生危害和流行,给推广面积较大的嘎啦和富士品种苹果生产造成了严重危害。选用抗病品种、冬季果园卫生、果实套袋、病害预测预报、施用高效低度杀菌剂和交替用药等病害综合防控措施,在病害控制、降低防治成本和促进果农增收等方面已取得了较大进展(Didelot et al. 2010;Parisi et al. 2013;Holb et al. 2017),但在病害流行季节,化学防治仍是主要手段。在果园,为了有效控制苹果黑星病的发生流行与危害,果农从花期至收获期每间隔7-10d喷施一次杀菌剂,大剂量和频繁施用杀菌剂加速降低了病原菌对杀菌剂的敏感性,从而导致抗药性产生(Brent & Hollomon 2009)。
腈菌唑(myclobutanil)作为甾醇脱甲基抑制剂类(DMIs)杀菌剂,因其对多数植物病害具有较好的防治效果,是目前果园病害常用的防治药剂(Braunp & Mcrae 1992;Bolton et al. 2016)。然而,Roberts & Crute(1994)、Steran et al.(1997)、Gessler et al.(2006)和王华等(2011)证实,由于果园长期频繁使用腈菌唑促进了病原菌抗药性产生,从而造成病害防治效果逐年降低。Koller et al.(1991)和Smith et al.(1991)研究认为,苹果黑星菌对腈菌唑这类杀菌剂的抗药性,是随田间杀菌剂使用浓度、使用频率和使用时间等因素的影响而逐步累积发展起来的,而且病原菌个体之间对不同杀菌剂的敏感性差异较大。为了监测病原菌田间抗药性发展和田间施用杀菌剂是否存在防治风险,建立病原菌对杀菌剂的敏感性基线尤为必要(周明国等 1994;符雨诗等2015)。基于此,本研究从新疆长期未施用任何杀菌剂的废弃苹果园中采集了37个苹果黑星病样品,并分离获得了相应病菌菌株。采用分生孢子萌发法和菌丝生长速率法测定了上述菌株对腈菌唑的敏感性,建立了敏感性基线,旨在为该地区苹果黑星菌田间抗药性监测和病害防治提供理论指导。
1 材料与方法
1.1 供试材料
1.1.1 菌株来源:从新疆伊犁长期未施用任何杀菌剂的废弃苹果园中采集了37个苹果黑星病样品。
1.1.2 试剂:20%腈菌唑水剂(Systhane 200g/L EW,Dow AgroSciences Limited,Hitchin,UK);利福霉素(Rifamycine,Sigma);琼脂粉(Oxoid Ltd.,Basingstoke,Hampshire,England);PDA培养基(Difco laboratories,Detroit,Michigan,USA)。
1.2 病菌敏感性测定
1.2.1 分生孢子芽管伸长法:样品采集与分生孢子悬浮液制备:在果园中按对角线多点随机取样方法,以每棵树为样本单位,采集苹果黑星病发病症状明显、病斑上产孢新鲜的病叶放入无菌塑料袋中,做好标记保存于冰壶中,及时带回实验室。在室内挑选产孢新鲜的单个病斑用经灭菌的打孔器(直径4mm)切下,置于1.5mL的无菌离心管中,在室温下风干后贮存于4℃冰箱中备用。使用时向每个离心管中加入适量的无菌水(1.0mL),静置30min使病斑充分软化,然后置于微型振荡仪(Sceentific Industries,INC,Bohemia,N.Y.,USA)旋转振荡30s,使病斑上的分生孢子充分释放于水中,用经灭菌的双层纱布过滤获得分生孢子悬浮液。在双目显微镜下检测分生孢子悬浮液的孢子浓度,将其调节为1×104个分生孢子/mL菌悬液。
1.2.2 测试培养基制备:以Koller et al.(1991)检测美国苹果黑星菌野生型菌株的EC50值(0.46mg/L)时的药剂浓度作为参考。在60℃时,将腈菌唑溶于1%琼脂培养基中,并将培养基中腈菌唑的含量分别调节成0、0.05、0.10、0.50、1.00mg/L。为控制细菌污染,培养基溶液中同时加入利福霉素,其最终浓度为0.05mg/L,培养基充分摇匀后在一次性无菌塑料培养皿(直径9cm)中倒入培养基15mL,待凝固后备用。
药剂浓度和检测时间筛选:为了建立苹果黑星病菌对腈菌唑的敏感性基线,确定腈菌唑抑制苹果黑星病菌分生孢子芽管伸长的药剂浓度和适宜检测时间,从田间采集的37个苹果黑星病样品中随机选取5个按照前述分生孢子悬浮液制备方法,在超净工作台上用经灭菌移液管吸取100μL分生孢子悬浮液于制备好含腈菌唑的1%琼脂培养基上,用经消毒的玻璃棒将其均匀涂抹在培养基表面,风干后盖皿倒置,于20℃恒温培养箱中培养。设置5个浓度处理的含腈菌唑药剂的琼脂培养基,包括无药剂空白对照处理。每个处理接种分生孢子悬浮液3皿,设3次重复。培养基接种分生孢子悬浮液2、4、8、16、24、36、48、60、72h后,在显微镜下(目镜10×,物镜10×)对分生孢子萌发的芽管长度进行测量,每个培养皿测定分生孢子萌发芽管数30个。
苹果黑星菌分生孢子对腈菌唑的敏感性测定:从田间采集的另外22个苹果黑星病样品在室内测定其分生孢子对腈菌唑的敏感性。在试验中,除培养基接种分生孢子悬浮液60h后对分生孢子萌发的芽管长度进行测量外,其他如分生孢子悬浮液的制备方法、琼脂培养基含腈菌唑药剂的浓度处理、试验对照与重复、分生孢子悬浮液接种方法与接种量、培养温度和镜检方法等均与前述相同。
1.2.3 生长速率法:对15个苹果黑星菌样品按上述方法获得分生孢子悬浮液后,进行单孢分离(包括5个源于采用分生孢子芽管伸长法测定的样品)。吸取15µL于未加杀菌剂的琼脂培养基培养,而后用微量移液器向培养基上滴加分生孢子菌悬液的位置再滴加35µL无菌水充分混匀,用经消毒的玻璃棒将分生孢子悬浮液均匀涂抹在培养基表面,风干后盖皿倒置于16℃恒温培养箱中培养24h。在超净工作台内显微镜下挑取萌发的单个分生孢子移入已制备好的PDA培养基上,并置于20℃恒温培养箱中培养4周后,转接于PDA试管培养基中继续培养用于保存。
菌丝体培养:在超净工作台内,向菌丝已长好的PDA平板上滴加5mL无菌水,小心用拨针剥离培养基表面生长好的菌丝,并移入加有5mL无菌水的试管内中,充分振荡形成混合均匀的菌悬液,在无菌条件下吸取100µL菌悬液加入已制好的PDA平板上,将菌丝悬浮液用经消毒的玻璃棒均匀地铺展在PDA平板表面,用Para膜密封后置于20℃的培养箱中培养4周后备用。
无菌条件下,在上述已培养好的各菌株菌落边缘生长较为均匀一致的地方,用经灭菌的直径4mm的打孔器打取菌饼,然后将菌饼上表面朝下置于添加有不同浓度的腈菌唑平板上,对于每个菌株的不同浓度均设置3个重复,共计9个菌饼(每个培养皿中正三角形放置3个菌饼)。接菌后,培养皿经膜密封后置于20℃培养箱中培养。在20d和40d时用游标卡尺十字交叉法对菌落直径进行测量,而后用测得的直径减去菌饼本身4mm的直径即得到菌落的净生长值,因20d和40d测定的值相关性较高,所以用40d的测定值用于统计分析。
1.3 数据处理
敏感性测定数据用Excel 2003进行处理,并通过SPSS17软件对菌丝生长抑制率几率值和药剂浓度对数之间的线性回归分析求出药剂的EC50值,同时,通过该软件就供试菌株对杀菌剂的敏感性分布频率进行分布类型检验,用最小差异显著法分析菌株培养时间、药剂浓度处理对菌株敏感性测定值间的差异显著性。其中相对抑制率(%)=(对照分生孢子芽管净增长值-处理分生孢子芽管净增长值)×100/对照分生孢子芽管净增长值,采用GraphPad Prism 8.0软件进行作图。
2 结果与分析
2.1 相对抑制率的测试时间和药剂测试浓度
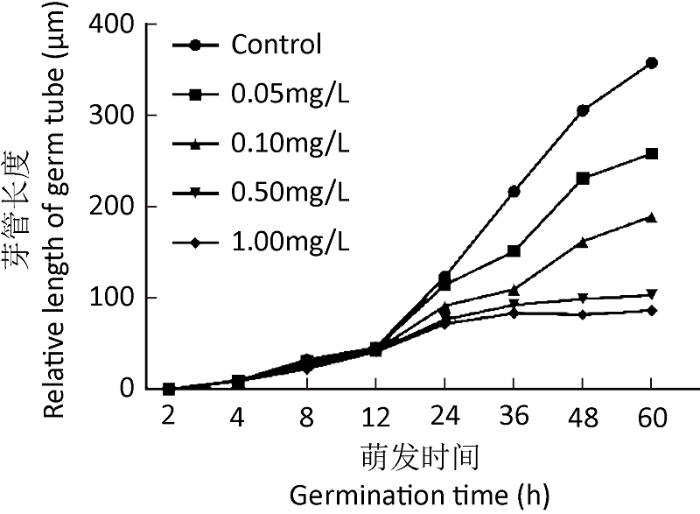
在药剂0.05mg/L浓度下,12、24、36、48、60h时野生型菌株的相对抑制率分别为1.9%、7.4%、30.3%、24.3%、27.8%;在0.5mg/L浓度下,相应的相对抑制率值分别为9.2%、38.1%、57.5%、67.7%、71.3%;在1.0mg/L浓度下,相对抑制率值分别为11.1%、42.0%、61.5%、73.3%和76.0%。在1.0mg/L浓度下的测定结果表明,从12h到24h相对抑制率值从11.1%增加到42.0%,差异值为30.9%;而从24h到36h,差异值为19.5%。从36h到48h,差异值缩减到11.8%,而48h到60h时,这一变化仅为2.7%,这也是48h到60h时其他浓度的相对抑制率变化情况:在相应药剂浓度下,相对抑制率的差异值分别为3.4%、0.2%和3.6%(图1),因此,依据从48h到60h时各个浓度间的相对抑制率变化差异不大以及60h后因为菌丝太长、在皿中盘延弯曲而难以准确测出的情况下,此时的测量值基本可以代表腈菌唑对苹果黑星菌的抑制效果。差异显著性分析也表明在48h到60h时相应浓度下的相对抑制率之间未有显著差异(P=0.051)。考虑到60h时的测量结果更接近真实值,而在72h后无法测得较为准确数值(在72h后,对照菌丝长度通常超过培养基的边缘而蜿蜒伸长,标准的长度难以测出),因此,在敏感性分布中选定60h时的测定值。另外,就设定测试药剂浓度而言,1.0mg/L的杀菌剂浓度足可测算出苹果黑星菌野生型菌株对腈菌唑的敏感性差异(P=0.001)。
图1
图1
不同时间、浓度条件下腈菌唑对苹果黑星菌分生孢子芽管伸长的影响
Fig. 1
Effects of various concentrations of myclobutanil on conidial germ tube elongation of Venturia inaequalis at different germination time.
2.2 苹果黑星菌对腈菌唑敏感性
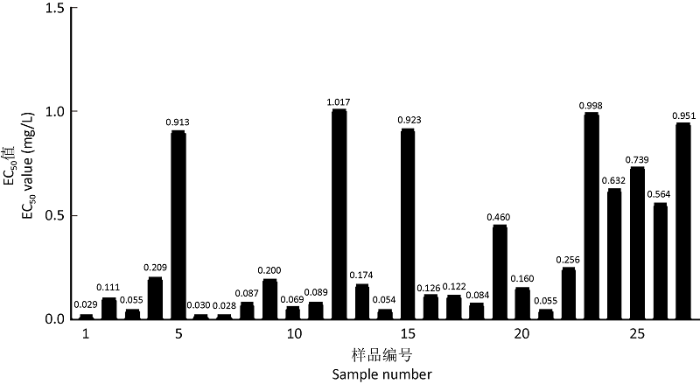
2.2.1 分生孢子萌发法测定的敏感性:分生孢子萌发法测定的结果表明,在供试菌株群体中有一小部分菌株在相当低浓度腈菌唑存在下可被有效抑制,EC50值分布范围为0.028-0.099mg/L,在这个群体中存在10个菌株,占总数的37.04%。在其他部分敏感性较低的群体中,仍有7个菌株的EC50值小于0.200mg/L(分布范围为0.111-0.184mg/L,占总数的25.93%)。这也意味着在野生型菌株群体中,有多达62.96%的菌株对于较低浓度的腈菌唑亦表现为极度敏感,这也构成了野生型菌株对于腈菌唑反应表现敏感性的群体基础。在其余菌株中,有4个菌株的EC50值分别为0.200、0.209、0.256和0.458mg/L,低于Koller et al.(1991)设定的苹果黑星菌对腈菌唑抗性转变的临界值0.460mg/L。然而,仍有一小部分菌株在杀菌剂浓度较高时仍然未能得到有效抑制,有6个菌株的EC50值高于0.460mg/L,但低于1.000mg/L,其分布范围为0.564-0.998mg/L。对12号菌株来说,其EC50值高达1.017mg/L,依据对于野生型菌株的EC50值设定的阈值来说,这部分菌株应被归于不敏感性群体中,总共27个菌株的平均EC50值为0.338mg/L(图2)。
图2
图2
分生孢子悬浮液法测定的苹果黑星菌对腈菌唑敏感性 EC50=0.338mg/L
Fig. 2
Baseline sensitivity of Venturia inaequalis to myclobutanil in spore suspension. EC50=0.338mg/L.
2.2.2 菌丝生长速率法测定的敏感性:在生长速率法测定菌株的敏感性反应中,数据源于以纯培养的单个病原菌孢子培养菌落作为对照,随后测定了在添加不同浓度杀菌剂的培养皿中菌落生长量的净增长值。在测试的菌株中有10个菌株的EC50值小于0.200mg/L,占到总数的66.67%,特别是在这个群体中多达8个菌株的相对抑制率的EC50值低于0.100mg/L。剩余菌株中仍有3个菌株的EC50值低于0.460mg/L(Koller等设定的苹果黑星菌对于腈菌唑抗性转变的临界值)。在该方法中,总共有86.67%的菌株群体对腈菌唑的反应表现为较敏感,但同时有2个菌株的EC50值表现为不敏感性特征:其EC50值分别高达0.682mg/L和0.798mg/L。另外,测试结果显示,尽管敏感菌株的比率高于分生孢子悬浮液法测得的数值,然而,相同菌株在生长速率法中对腈菌唑敏感性的测定结果显示,供试菌株同分生孢子悬浮液测定的结果较为一致(P=0.0001,r=0.934),即绝大部分菌株仍然是敏感的。尽管伴随着敏感性较低的菌株,这个组的平均EC50值为0.223mg/L(图3),高于其他部分已发表的关于苹果黑星菌对腈菌唑敏感性反应的测试值(Hildbrand et al. 1988;Koller et al. 1991;Jobin & Carisse 2006)。
图3
图3
生长速率法测定的苹果黑星菌对腈菌唑的敏感性 EC50=0.223mg/L
Fig. 3
Baseline sensitivity of Venturia inaequalis to myclobutanil determined by monoconidial hyphal growth rate method. EC50=0.223mg/L.
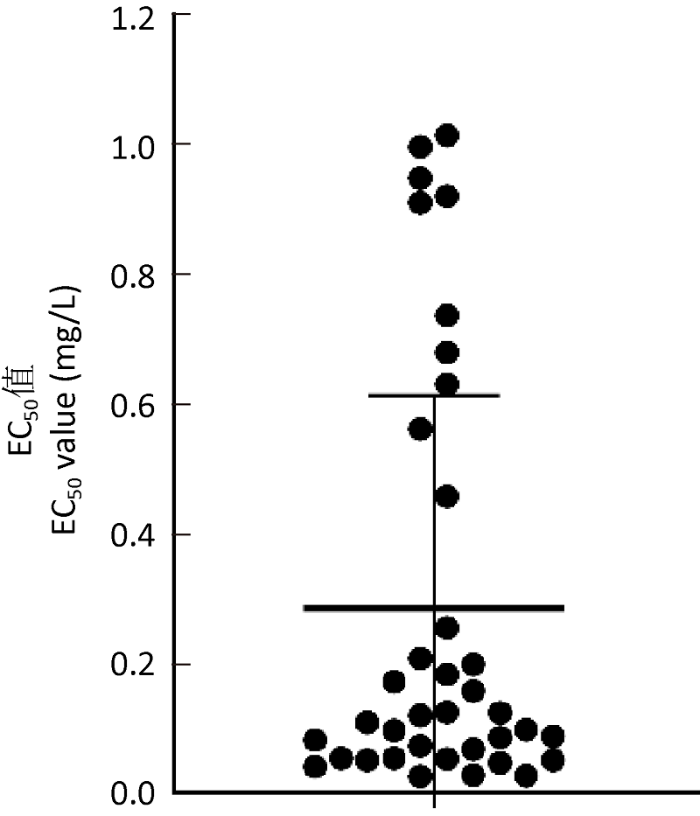
2.2.3 苹果黑星菌菌株对腈菌唑敏感性基线:本试验测试了苹果黑星菌野生型菌株群体对腈菌唑的敏感性反应,因为废弃果园从未施用过农药,有理由认为测试值可以代表苹果黑星菌群体的自然敏感性。在测试的菌株中,有20个菌株对低浓度腈菌唑的反应表现为极度敏感,其平均EC50值为0.062mg/L(范围为0.028-0.099mg/L)。共有28个菌株的平均EC50值(0.113mg/L,分布范围为0.028-0.432mg/L)低于Koller et al.(1991)设定的苹果黑星菌对腈菌唑反应的抗感性转化阈值为0.460mg/L,占群体总数的73.68%。另外,依据苹果黑星菌对腈菌唑反应的抗感性转化阈值来说,有9个菌株的EC50值超过了这一数值,在野生型菌株群体中表现出了较高的不敏感性,但未见菌株的EC50测试值超过2.300mg/L,即通常认为超过平均值的5-10倍后就初步认为具有一定的抗药性(杨谦2012)。因此,可以将其群体EC50平均值(0.283mg/L)作为苹果黑星菌对腈菌唑反应的敏感性基线(图4)。同时,在群体的EC50测试值范围(0.028-1.017mg/L)内统计每个区间出现的菌株数和频率,检验结果显示供试菌株对腈菌唑的敏感性对数频率分布近似服从正态分布(W=0.7313,P=0.2471>0.05)。
图4
图4
苹果黑星菌对腈菌唑的敏感性基线分布图 EC50=0.283mg/L
Fig. 4
Frequency distribution for the baseline sensitivity of Venturia inaequalis to myclobutanil. EC50=0.283mg/L.
3 讨论
本研究测试了新疆地区苹果黑星菌对腈菌唑敏感性的EC50分布范围,旨在建立本地区苹果黑星菌对腈菌唑敏感性基线,从而为该地区苹果黑星菌田间抗药性监测和病害防治提供理论指导。试验中苹果黑星菌菌株对腈菌唑敏感性的EC50分布范围为0.028-1.017mg/L(平均0.283mg/L),其分布范围覆盖了在美国和加拿大(Hildbrand et al. 1988;Koller et al. 1991;Sholberg & Haag 1993;Sierotzki et al. 1994)发现的野生型菌株的EC50分布范围,且其平均EC50值高于以前报道的野生型菌株的平均EC50值,在纽约平均EC50值为0.070mg/L(Koller et al. 1991);在British Columbia为0.164mg/L(Sholberg & Haag 1993),在加拿大Annapolis Valley为0.055mg/L(Hildbrand et al. 1988),在Quebec为0.064mg/L(Jobin & Carisse 2006)。这些差别可能是由于病菌群体内固有的差别,但也可能是由于评估方法的差别。在本研究中,部分数值直接源于芽管伸长、单个苹果黑星病病斑冲洗的孢子,但源自单个病斑的孢子可能存在遗传差异。因此,得到的EC50值可能是这些病菌不同基因型的平均值,导致EC50值分布在一个较窄的范围内,但这可能只会影响EC50值的分布范围,而不是敏感性程度。关于野生型菌株中部分敏感性相对较低的菌株,因为在植物病原菌的抗药性指数中通常认为EC50值提高5-10倍以上为抗药性产生的标准,相对于另一个间歇性喷施DMI杀菌剂的果园中的平均EC50值为2.047mg/L,却仍能得到较好防治效果的苹果黑星菌群体来说,测试样品群体的EC50值显示其可能并未出现抗药性菌株,尽管这些个别敏感性较低的菌株可能是群体内固有的,也可能是以基因流的方式来自于应用了DMI杀菌剂的果园。但野生型群体中这部分敏感性相对较低的菌株仍然需要引起注意,有待进一步研究。
在实际生产中,野生型菌株群体被用来作为参考,以判断田间使用具有抗性风险的杀菌剂对于菌株是否继续有效,因此,鉴别剂量的设定在评判田间使用了杀菌剂后敏感性是否发生了转化则显得很重要。在本试验中,苹果黑星菌野生型菌株群体的敏感性是通过测试菌株对从0到1.0mg/L 剂量范围的杀菌剂反应的生物学方法获得的,这主要是基于Koller et al.(1991)将苹果黑星菌野生型菌株群体对腈菌唑抗性反应的阈值(0.460mg/L),因而,Koller et al.(1991)建议在评估病原菌对腈菌唑反应的田间抗性风险时,将略微高于这个阈值的浓度0.5mg/L设定为鉴别剂量。依据该测试结果,在测试苹果黑星菌对腈菌唑的反应时,将最高浓度设定为高于这个阈值的1.0mg/L。然而,尽管苹果黑星菌野生型菌株类群中绝大多数菌株对腈菌唑反应的EC50测试值均小于0.460mg/L,但仍然有个别菌株的EC50测试值高于1.0mg/L,这种情况类似于Hetherington & Gunning(2003)在澳大利亚的报道。在他们测试的苹果黑星菌野生型菌株群体对腈菌唑的敏感性反应中,部分菌株的EC50测试值高达0.970mg/L。显然,对于平均EC50值为0.070mg/L的野生型菌株群体来说,如果果园中日常喷施杀菌剂造成抗性发生明显的偏移时,0.5mg/L的鉴别剂量足够甄别出这种差异的发生。但问题是对于群体的平均EC50值为0.283或者略高于这个值的病原菌群体来说,依据前述苹果黑星菌对腈菌唑敏感性反应设置的0.5mg/L的鉴别剂量是否能够区分病原菌的敏感性转化、对田间抗性的偏移作出正确的决策,进而用于田间病害防治策略的调整,仍值得深入讨论。
显然,作为苹果黑星菌野生型菌株类群,试验中仍然有部分菌株具有较高的不敏感性(9个菌株的EC50值分布范围从0.564-1.017mg/L),但表现出明显的抗性特征。在这些测试的野生型菌株群体中,部分菌株对腈菌唑敏感性反应的EC50测试值高于敏感性发生转变的阈值0.460mg/L,这部分菌株值得密切关注。作为对特定杀菌剂具有抗性特征的组成部分,这些不敏感菌株可能源于内在的遗传改变,如基因突变等,而且作为一种能产生有性孢子的子囊菌,在特定的环境下容易发生菌株交配实现基因重组也会赋予菌株一定的抗性特征。尽管大多数突变是无益的或新形成的突变体并不具有较高的环境适应性,然而,在具有相同作用机制的杀菌剂的选择下,存活的抗性突变体可通过频繁使用杀菌剂处理而逐步累积,即在被测试出之前,其会经过一个不易被发现的导致田间防治失败的较高水平抗性的累积过程(Koller et al. 1991;Smith et al. 1991)。另外,菌株遗传变化的另一个重要性在于对防治策略的诠释,如在数次或数个季节施用杀菌剂后,如果部分亲本菌株的后代孢子谱系仍然对杀菌剂敏感而另一部分显然表现为明显的抗性,则可认为亲本菌株存在遗传异质性,在菌株类群中的不敏感菌株群体在近期内仍然可以有效地被腈菌唑所控制,然而,随着频繁应用这类杀菌剂,这些不敏感菌株会迅速繁殖,随着这些菌株在病菌群体中自然频率的增长,在杀菌剂的选择压力下,整个病菌群体中不敏感菌株会逐渐呈梯度性向对杀菌剂不敏感性的方向发生偏移,从而导致田间使用杀菌剂时对不敏感菌株丧失防效。
参考文献
RNA-sequencing of Cercospora beticola DMI-sensitive and -resistant isolates after treatment with tetraconazole identifies common and contrasting pathway induction
Composition of a Venturia inaequalis resistant to myclobutanil
Fungicide resistance, the assessment of risk FRAC Monograph. 2nd ed. Fungicide Resistance Action Committee,
Integrating scab control methods with partial effects in apple orchards: the association of cultivar resistance, sanitation and reduced fungicide schedules. Bulletin Oepp /
Baseline sensitivity to fludioxonil of Penicillum digitatum population from citrus in China
Venturia inaequalis resistance in apple
Myclobutanil resistance in an isolate of Venturia inaequalis from New South Wales
Resistance of Venturia inaequalis to bitertanol and other demethylation-inhibiting fungicides
On-farm and on-station evaluations of three orchard management approaches against apple scab and apple powdery mildew
Fungicide resistance in apple scab in the province of Quebec: an overview of the problem and its implications for disease management. Bulletin Oilb/
Baseline sensitivities of Venturia inaequalis to sterol demethylation inhibitors
Apple scab: biology, epidemiology, and management. American Phytopathological Society, St
Research methods on plants chemical protection
Effects of post infection applications of ergo sterol biosynthesis-inhibiting fungicides on lesion formation and pseudothecial development of Venturia inaequalis
Impact of a cultivar mixture on scab, powdery mildew and rosy aphid in an organic apple orchard
Apple scab resistance from Malus floribunda 821(Vf) is rendered ineffective by isolates of Venturia inaequalis from Malus floribunda
Sensitivity of Venturia inaequalis isolates from British Columbia to flusilazole and myclobutanil
Detection of variation in virulence toward susceptible apple cultivars in natural populations of Venturia inaequalis
Sensitivity distribution of Venturia inaequalis to the sterol demethylation inhibitor flusilazole: baseline sensitivity and implications for resistance monitoring
Acquisition of resistance to sterol demethylation inhibitors by populations of Venturia inaequalis
Field trial of six fungicides for controlling the apple scab
Technology guidance on plant protection chemical experiments
Molecular biology of plant pathogen resistance
Progress of fungicide resistance research