外生菌根(ectomycorrhizae,EM)是土壤真菌与植物根系形成的互惠共生体,能增强宿主植物的养分吸收能力和抗逆性,而EM真菌(EM fungi,EMF)则从宿主植物中获得所需的碳源物质(Smith & Read 1997)。菌根际(mycorrhizosphere)是菌根真菌侵染植物根系形成菌根共生体与土壤之间相互作用的微生态系统(Linderman 1988)。其中,定殖在根内和根际中的微生物对土壤养分的活化与循环、植物生长与抗逆起着关键性作用。近年来,菌根真菌与根际土壤微生物间的互作关系成为了微生物学的研究热点(刘润进和陈应龙 2007)。菌根际是复杂的微生态区域,根际微生物能调控菌根的形成,而菌根真菌亦对根际微生物的种类具有特异选择性(盛江梅和吴小芹 2007)。例如,菌根辅助细菌(mycorrhiza helper bacteria,MHB)和植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)是菌根际重要的微生物类群,它们对于菌根形成、宿主植物生长扮演着不可或缺的角色。目前多数研究关注某类EMF与单一促生菌间的互作机制(Labbéet al. 2014 ;宋小双等 2015),但涉及特定生境内的复合功能群研究较少。随着新一代高通量测序技术的高速发展,避免了传统分离培养的技术限制,能真实反映菌根际微生态区种群结构,将有助于揭示菌根际微生物之间的互作机制。
红锥Castanopsis hystrix Miq.和马尾松Pinus massoniana Lamb.为我国亚热带地区广泛分布的典型的EM用材树种。目前,针对马尾松EMF多样性的研究较多(罗国涛等 2007;李敏 2016),但涉及红锥林EMF资源的研究仍鲜有报道。然而,单一种植的人工纯林会造成土壤养分元素亏缺(Epron et al. 2015 ),进而导致土壤微生物群落结构的改变,特别是植物-土壤微生物共生关系的失衡往往会导致一些关键功能类群缺失。相反,混交林能改善土壤微生物群落结构和组成,有效促进林内的土壤养分循环(Huang et al. 2016 )。针阔混交在林业生产中已获得了良好的效果,而红锥-马尾松混交已被证实是培育阔叶树种大径材的典型针阔混交组合(郭文福等 2010)。红锥和马尾松混交能显著促进林木生长,提高造林存活率和林分生产力(郭文福等 2010;覃林等 2011),但对其混交林下的微生物群落结构知之甚少。以往的研究较多关注菌根和根际土壤其一的真菌多样性,缺少同时对定殖在菌根内和根际土壤微生物群落的研究。本研究以广西凭祥20年生红锥-马尾松混交林为研究对象,利用Illumina MiSeq高通量测序分析该混交林内两树种的菌根际(外生菌根和根际)微生物群落组成,探讨土壤理化性质对微生物群落组成、分布的影响,初步揭示菌根际共生真菌与菌根促生细菌的共存关系,为菌根际复合菌剂的研发提供理想的菌群组合,也为该区域内的低质低效林分改造提供理论依据。
1 材料与方法
1.1 样品采集与处理
研究样品于2019年5月采自位于广西凭祥中国林业科学研究院热带林业研究中心青山林场(E106°44′16.72″,N22°10′55.24″)的20年生红锥-马尾松混交人工林,属南亚热带季风型气候区,年均降雨量1 400mm,年均气温21.5℃,土壤为山地棕壤土。利用索根法沿树的主干3个方向分别采集红锥和马尾松树下细根(直径<2mm),并收集距根表小于5mm的土壤作为根际土。每个树种随机取间距至少5m以上的9棵标准木进行样品采集,采集好的样品装在有标记的自封袋中。采集好的样品红锥、马尾松根样和根际标记为HZ-EM、HZ-RS和MWS-EM、MWS-RS。土样带回实验室过孔径为2mm的筛后分为两份,一份储存于-80℃冰箱用于测序;另一份自然风干,部分继续过0.25mm筛后用于土壤理化性质检测。将根样置于筛中用自来水清洗干净后,选取新鲜的菌根根尖7-9个用滤纸吸干水分后置于1.5mL灭菌离心管中,-80℃保存,用于分子鉴定。
1.2 测序分析
菌根样在液氮中冻干,然后在球磨机中研磨成细粉。使用FastDNA®Spin Kit for soil(MP Biomedicals,Santa Ana,CA)试剂盒分别提取根际土和菌根基因组DNA。利用引物ITS1F(5ʹ-CTTGGTCATTTAGAGGAAGTAA-3ʹ)和ITS2R(5ʹ-GCTGCGTTCTTCATCGATGC-3ʹ)对真菌ITS1区进行扩增(Buéeet al. 2009 )。20μL反应体系:4μL 5×FastPfu Buffer,2μL dNTPs(2.5mmol/L),0.8μL上下游引物(5μmol/L),0.4μL FastPfu polymerase,0.2μL BSA,DNA模板(10ng),ddH2O定容。循环参数:95℃预变性3min,35个循环(95℃变性30s;55℃退火30s;72℃延伸45s),最后72℃延伸10min。利用338F(5ʹ-ACTCCTACGGGAGGCAGC AG-3ʹ)和806R(5ʹ-GGACTACHVGGGTWTCTAA T-3ʹ)对细菌16S rRNA V3-V4区进行测序(Guo et al. 2018 )。20μL反应体系:2μL 10×Buffer,2μL dNTPs(2.5mmol/L),0.8μL上下游引物(5μmol/L),0.2μLrTaqpolymerase,0.2μL BSA,DNA模板(10ng),ddH2O定容。循环参数:95℃预变性3min,27个循环(95℃变性30s;55℃退火30s;72℃延伸45s),最后72℃延伸10min。2%琼脂糖凝胶电泳检测PCR产物,合格产物利用Illumina MiSeq平台进行测序,测序由深圳微生太科技有限公司完成,GenBank登录号SRP281810。
1.3 土壤化学性质的测定
土壤样品由中国林业科学研究院热带林业研究所理化分析室检测。土壤pH采用电位法测定(土:水=1:2.5);土壤有机质(SOM)采用重铬酸钾容量法测定(NY/T 85-1988);全氮(TN)采用半微量凯氏定氮法测定(NY/T 53-1987);全磷(TP)采用硫酸-高氯酸消煮法测定(NY/T 88-1988);全钾(TK)氢氧化钠熔融-火焰光度法测定(NY/T 87-1988);有效磷(AP)采用0.5mol/L碳酸氢钠-钼锑抗比色法测定(Olsen et al. 1954 );有效钾(AK)采用1mol/L醋酸铵-火焰光度法测定(NY/T 889-2004)(表1)。
表1 红锥和马尾松土壤理化性质的比较
Table 1
| 名称 Name | pH | 有机质 SOM (g/kg) | 全氮 TN (g/kg) | 全磷 TP (g/kg) | 全钾 TK (g/kg) | 有效磷 AP (mg/kg) | 有效钾 AK (mg/kg) |
|---|---|---|---|---|---|---|---|
| 红锥 C.hystrix | 4.78±0.07 | 52.0±1.7a | 2.63±0.07a | 0.50±0.02a | 10.44±0.33 | 2.45±0.16 | 146±8 |
| 马尾松 P.massonian | 4.90±0.09 | 46.8±1.0b | 2.25±0.03b | 0.36±0.05b | 8.23±1.52 | 2.10±0.08 | 148±7 |
注:表中数据为平均值±标准误,不同字母表示同一列内各均值存在显著性差异(P<0.05)
Note: Data in the Table are mean ± standard error. Different letters in the same column mean significant difference among the mean values ( P<0.05).
1.4 微生物群落功能预测分析
使用FUNGuild(
1.5 统计分析
采用R 3.6.1、SPSS 24.0软件和Microsoft Excel进行数据处理和分析作图。SPSS进行单因素和双因素方差(one/two-way ANOVA)分析各变量的差异显著性。利用R语言vegan包计算α多样性指数,包括Shannon指数、Simpson指数和Chao1指数;Shannon指数和Simpson指数用来估算样品中OTU多样性的指数,Chao1指数是估计样品中所含OTU数目的指数。采用相似性分析(analysis of similarity,ANOSIM)和非度量多维标度(non- metric multidimensional scaling,NMDS)基于Bray-Curtis差异对组间微生物群落组成差异进行量化和可视化。冗余分析(redundancy analysis,RDA)土壤环境因子和优势菌群之间的相关性。所有分析显著性水平设置为P<0.05。
2 结果与分析
2.1 总测序结果
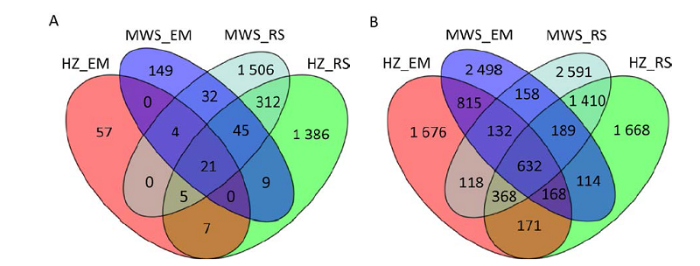
利用Illumina Miseq平台高通量测序,测序结果经质控后分别共得1 645 216条真菌和1 359 686条细菌序列,分别划分为3 533和12 708个OTU。其中,仅有21个真菌OTU和632个细菌OTU同时存在于红锥和马尾松菌根、根际土壤中,分别占OTU总数的0.59%和4.97%,但总相对丰度占比高达70.49%和47.86%(图1)。
图1
图1
真菌(A)和细菌(B)OTU数量关系
Fig. 1
The numerical relationships of fungal (A) and bacterial (B) OTU.
2.2 真菌群落结构
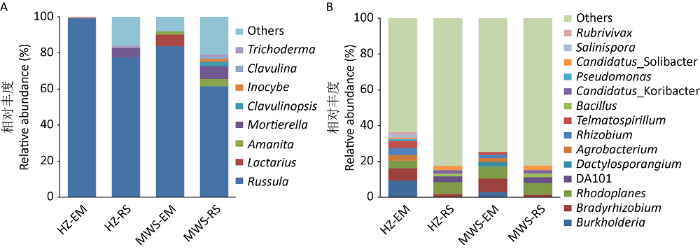
2.2.1 真菌群落组成:担子菌Basidiomycota和子囊菌Ascomycota是红锥-马尾松菌根际真菌的主要类群,总相对丰度达95.74%。红锥和马尾松菌根际相对丰度>1%的真菌属共有8个,两树种间的优势真菌属的相对丰度和群落结构存在较大差异(图2A)。红锥菌根真菌优势属仅有红菇属Russula(99.17%),根际真菌优势属有红菇属Russula(77.63%)、被孢霉属Mortierella(5.14%)和木霉属Trichoderma(1.19%)。马尾松菌根真菌优势属为红菇属Russula(83.67%)、乳菇属Lactarius(6.41%)和鹅膏属Amanita(1.92%),根际真菌优势属为红菇属Russula(61.5%)、鹅膏属Amanita(3.95%)、被孢霉属Mortierella(7.17%)、拟锁瑚菌属Clavulinopsis(2.45%)、丝盖伞属Inocybe(1.75%)、锁瑚菌属Clavulina(1.14%)和木霉属Trichoderma(1.09%)。其中,Russula为红锥-马尾松混交林下绝对优势类群(相对丰度>50%)。
图2
图2
优势真菌属(A)和优势细菌属(B)相对丰度
HZ-EM:红锥外生菌根;HZ-RS:红锥根际土;MWS-EM:马尾松外生菌根;MWS-RS:马尾松根际土. 下同
Fig. 2
The relative abundance of dominant fungal genera
(A) and dominant bacterial genera (B). HZ-EM: Castanopsis hystrixectomycorrhizae; HZ-RS: Castanopsis hystrixrhizosphere soil; MWS-EM: Pinus massonianaectomycorrhizae; MWS-RS: Pinus massonianarhizospheres soil. The same below.
2.2.2 红锥-马尾松菌根际共生真菌组成:使用FUNGuild进行真菌功能注释,共得到7种营养类群,共生真菌代表OTU有216个,包括丰度较大的EMF(84.75%)、杜鹃花类菌根真菌(ericoid mycorrhizal fungi,ERMF)(0.08%)、丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)(0.08%)和地衣共生真菌(lichenized fungi,LF)(0.007%)。其中,EMF是菌根和根际中共生真菌群落的主要类群,主要有Russula、Lactarius、Amanita、Clavulina、Rhizopogon、Tomentella、Pisolithus、Cenococcum、Suillus、Phylloporus、Cortinarius、Laccaria、Rossbeevera、Scleroderma、Sebacinaceae、Inocybaceae、Sebacinaceae、Russulaceae,丰度最大的是Russula(80.05%),其次为Lactarius(2%)和Amanita(1.46%);AMF主要包括Gigaspora、Acaulosporaceae、Gigasporaceae、Glomeromycota、Acaulospora、Paraglomerales、Glomeraceae、Dentiscutata、Diversisporales、Paraglomeraceae、Paraglomeraceae;ERMF仅有Oidiodendron 1个属;LF包括Ramalina、Verrucariaceae、Parmeliaceae。对红锥和马尾松菌根、根际共生真菌的相对丰度进行比较,结果表明根际中共生真菌种类较菌根丰富,红锥、马尾松菌根和根际中共生真菌均以EMF为主,且红锥菌根和根际EMF相对丰度均高于马尾松(表2)。
表2 菌根和根际土壤中共生真菌的相对丰度
Table 2
| Trophic mode | Guild | Relative abundance (%) (OTUs represented) | |||
|---|---|---|---|---|---|
| HZ-EM | MWS-EM | HZ-RS | MWS-RS | ||
| Symbiotroph | Ectomycorrhizal | 99.17(5) | 92.14(23) | 76.36(69) | 73.79(84) |
| Arbuscular mycorrhizal | 0 | 0 | 0.188(35) | 0.107(44) | |
| Ericoid mycorrhizal | 0 | 0.344(2) | 0.002(1) | 0.004(1) | |
| Lichenized | 0 | 0.002(1) | 0.015(5) | 0.009(5) | |
2.3 细菌群落组成
2.3.1 细菌群落结构:酸杆菌Acidobacteria、放线菌Actinobacteria和变形菌Proteobacteria是红锥-马尾松菌根际细菌的主要类群,总相对丰度达78.71%。红锥和马尾松菌根际相对丰度>1%的细菌属共有14个,两树种菌根和根际优势细菌属的相对丰度和结构存在较大差异(图2B)。红锥和马尾松菌根中有丰度较高的伯克霍尔德氏菌属Burkholderia(9.26%,2.89%)、慢生根瘤菌属Bradyrhizobium(6.88%,7.51%)、根瘤菌属Rhizobium(3.78%,1.87%)、土壤杆菌属Agrobacterium(3.2%,2.1%)、Rhodoplanes(4.26%,6.58%)、假单细胞菌属Pseudomonas(1.13%,0.71%)、指孢囊菌属Dactylosporangium(0.67%,2.78%)、Telmatospirillum(4.08%,1.63%)、盐孢菌属Salinispora(1.65%,0.32%)和Rubrivivax(1.41%,0.5%)。红锥和马尾松根际优势细菌属有Rhodoplanes(6.67%,6.55%)、慢生根瘤菌属Bradyrhizobium(1.79%,1.36%)、芽孢杆菌属Bacillus(1.54%,2.13%)、DA101(3.2%,3.3%)、Candidatus_Koribacter(1.91%,1.79%)和Candidatus_Solibacter(2.47%,2.55%)。
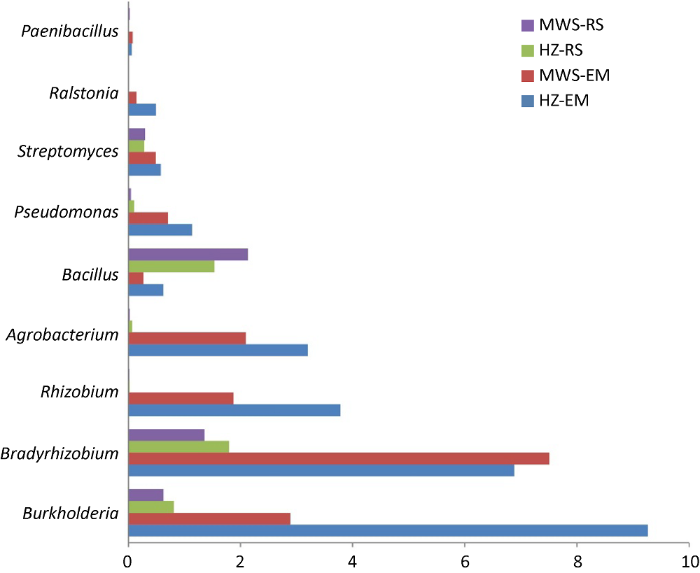
2.3.2 红锥-马尾松菌根际菌根辅助细菌组成:红锥-马尾松混交林下菌根际MHB有伯克霍尔德氏菌Burkholderia、慢生根瘤菌属Bradyrhizobium、根瘤菌属Rhizobium、土壤杆菌属Agrobacterium、假单细胞菌属Pseudomonas、芽孢杆菌属Bacillus、类芽胞杆菌属Paenibacillus、放线菌链霉菌属Streptomyces、节杆菌属Arthrobacter、肠杆菌属Enterobacter和罗尔斯顿菌属Ralstonia。其中,Burkholderia、Pseudomonas、Bradyrhizobium、Rhizobium、Agrobacterium、Streptomyces、Paenibacillus、Ralstonia在两树种菌根中的相对丰度远远高于根际,而根际中Bacillus相对丰度高于菌根。此外,结果发现Enterobacter只存在于菌根,而Arthrobacter只存在于根际(图3)。
图3
图3
菌根和根际土壤中MHB的相对丰度
Fig. 3
Relative abundance of mycorrhiza helper bacteria in ectomycorrhizae and rhizosphere soil.
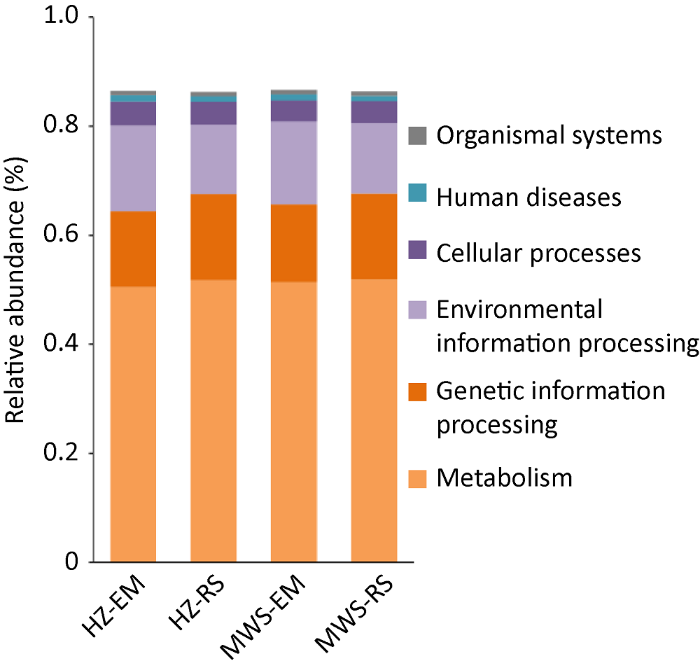
2.3.3 细菌群落功能分析:使用PICRUST基于KEGG数据库进行细菌功能预测与注释,结果表明,菌根和根际中的细菌在一级代谢功能层共获得6类生物代谢通路(图4),其中,代谢(metabolism)、遗传信息处理(genetic information processing)和环境信息处理(environmental information processing)3个通路为菌根和根际土壤中细菌群落的主要通路,在红锥和马尾松菌根、根际中的丰度并无明显差异。
图4
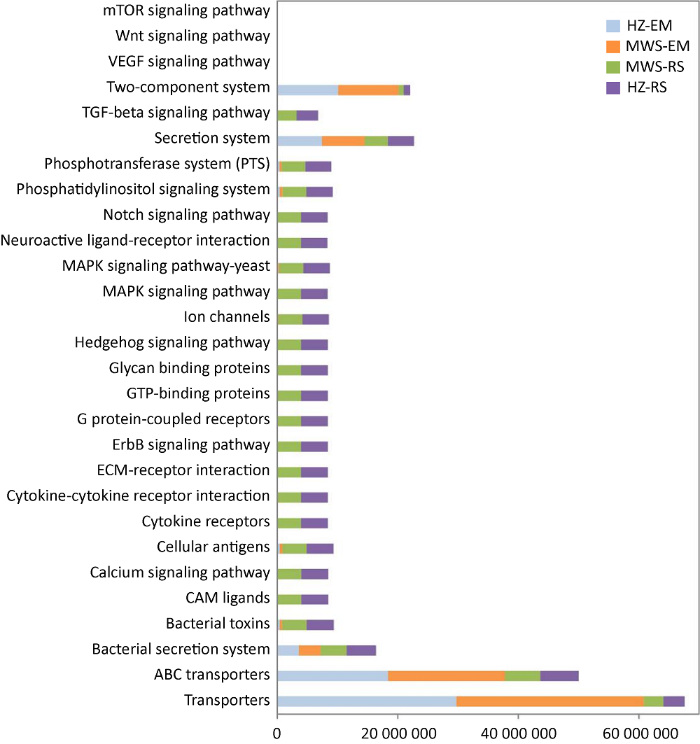
通过环境信息处理相关的代谢通路来探讨菌根际细菌与菌根共生真菌类群的共存关系。环境信息处理由3个二级通路组成:膜运输通路(membrane transport)、信号转导通路(signal transduction)与信号分子和相互作用通路(signaling molecules and interaction)。而membrane transport又由5个三级通路组成(ABC transporters、bacterial secretion system、phosphotransferase system (PTS)、secretion system、transporters);signal transduction由12个三级通路组成:calcium signaling pathway、ErbB signaling pathway、hedgehog signaling pathway、MAPK signaling pathway、MAPK signaling pathway-yeast、notch signaling pathway、phosphatidylinositol signaling system、TGF-beta signaling pathway、two-component system、VEGF signaling pathway、Wnt signaling pathway和mTOR signaling pathway;signaling molecules and interaction由11个三级通路组成:bacterial toxins、CAM ligands、cellular antigens、cytokine receptors、cytokine-cytokine receptor interaction、ECM-receptor interaction、G protein-coupled receptors、GTP-binding proteins、glycan bindng proteins、ion channels和neuroactive ligand- receptor interaction。
在环境信息处理三级代谢功能通路中,ABC transporters和transporters的丰度较高。基于菌根与根际中细菌三级代谢功能通路丰度的比较,发现红锥和马尾松菌根中部分膜运输通路(ABC transporters、transporters和secretion system)和信号转导通路(two- component system)的丰度高于根际;膜运输通路(PTS)、信号转导功能通路(phosphatidylinositol signaling system)与部分信号分子和相互作用通路(bacterial toxins、cellular antigens和ECM-receptor interaction)的丰度低于根际(图5)。而cytokine receptors、cytokine-cytokine receptor interaction、ErbB signaling pathway、G protein-coupled receptors、GTP-binding proteins、hedgehog signaling pathway、MAPK signaling pathway、TGF-beta signaling pathway和mTOR signaling pathway只存在于根际。
图5
图5
细菌群落的三级代谢功能分析
Fig. 5
Analysis of metabolic function at third level for bacterial communities.
2.4 微生物群落结构差异
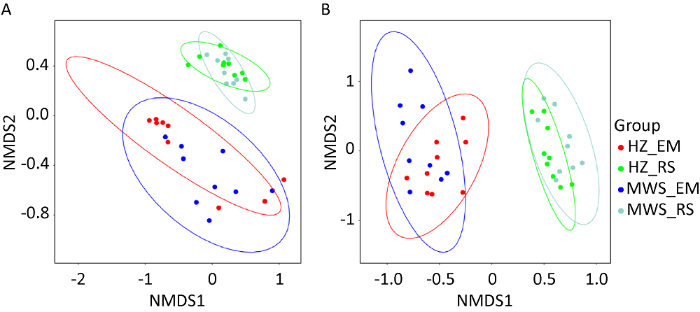
基于Bray-Curtis距离进行NMDS和ANOSIM(999 permutations)分析,结果显示红锥和马尾松菌根、根际微生物群落明显分离(图6),ANOSIM分析表明菌群结构差异显著(Fungi R=0.09,P=0.031;Bacteria R=0.72,P=0.001)。红锥和马尾松林下根际微生物群落(HZ-RS与MWS-RS)、菌根微生物群落(HZ-EM与MWS-EM)结构分别具有相似性。
图6
图6
真菌(A)和细菌(B)群落基于Bray-Curtis距离进行NMDS排序
Fig. 6
Non-metric multidimensional scaling (NMDS) ordination of fungal (A) and bacterial (B) communities based on Bray-Curtis distance.
2.5 微生物群落多样性
微生物群落α多样性分析结果见表3。Chao1指数、Shannon指数和Simpson指数显示红锥和马尾松根际微生物群落丰富度和多样性均高于菌根。在真菌群落中,红锥林地根际土壤营养积累丰富,但其菌根和根际真菌多样性显著低于马尾松。与真菌群落不同,红锥和马尾松菌根(HZ-EM与MWS-EM)、根际(HZ-RS与MWS-RS)细菌群落多样性无明显差异,但菌根和根际间差异显著(HZ-EM与HZ-RS;MWS-EM与MWS-RS)。总体上,马尾松菌根际微生物群落丰富度和多样性较高。
表3 微生物群落的α多样性指数
Table 3
| 群落 Groups | Chao1指数 Chao1 index | Shannon指数 Shannon index | Simpson指数 Simpson index | |||
|---|---|---|---|---|---|---|
| Fungi | Bacteria | Fungi | Bacteria | Fungi | Bacteria | |
| HZ-EM | 12.78±2.62b | 838.0±35.5b | 0.20±0.11d | 7.77±0.13b | 0.07±0.05d | 0.98±0.00 |
| HZ-RS | 258.8±29.7a | 1 057.7±76.6a | 2.35±0.29b | 9.33±0.11a | 0.47±0.07b | 1.00±0.00 |
| MWS-EM | 34.2±5.3b | 873.2±60.6b | 0.95±0.31c | 7.60±0.22b | 0.26±0.09c | 0.97±0.01 |
| MWS-RS | 271.9±18.4a | 1 223.4±194.8a | 3.19±0.34a | 9.34±0.15a | 0.65±0.07a | 1.00±0.00 |
注:表中数据为平均值±标准误差,不同字母表示同一列内各均值存在显著性差异(P<0.05)
Note: Data in the Table are mean ± standard error. Different letters in the same column mean significant difference among the mean values ( P<0.05).
2.6 微生物群落优势菌与土壤理化性质的相关性
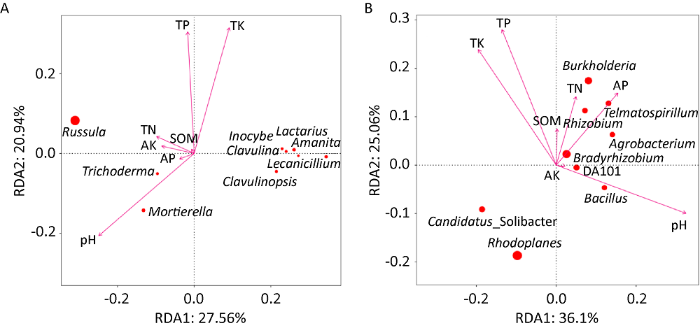
红锥和马尾松根际土壤理化性质存在差异(表1)。红锥根际土壤除AK略低于马尾松外,其他养分含量均高于马尾松,且SOM、TN和TP存在显著性差异;红锥和马尾松土壤均呈酸性。总体来说,红锥根际土壤营养积累较为丰富。对优势真菌和细菌在属水平的相对丰度与土壤理化因子进行冗余分析(RDA,图7),结果显示真菌和细菌丰度分布第1轴和第2轴累计解释变异量分别为48.50%和61.16%,表明解释变量对微生物群落分布具有一定影响。土壤理化因子对真菌的影响程度依次为TK>pH>TP>TN>AK>AP>SOM,对细菌的影响从大到小为pH>TP>TK>AP>TN> SOM>AK。由此可见,影响红锥-马尾松林下菌根际菌群分布和组成的主要理化因子是pH、TP和TK。
图7
图7
优势真菌属(A)和优势细菌属(B)与土壤理化性质的冗余分析
Fig. 7
Redundancy analysis (RDA) on dominant fungal genera (A) and dominant bacterial genera (B) constrained by soil physicochemical properties.
3 讨论
根系分泌物在招募菌根真菌和促生细菌中发挥重要作用(Vives-Peris et al. 2020 )。因此,根际作为连接土壤与植物的媒介受根系生理过程影响,所含土壤微生物种类丰富,是最复杂的生态系统之一(Raaijmakerset al. 2009 )。红锥、马尾松菌根与根际土壤微生物群落结构存在显著差异。α多样性指数分析表明,红锥、马尾松根际微生物群落多样性显著高于菌根。红锥根际土壤营养积累较为丰富(表1),但其真菌丰富度和多样性却显著低于马尾松。有研究发现EMF可以抑制AMF的生长(Chen et al. 2000 ),而EM和ERM的结合会使土壤酸化(Tedersoo et al. 2020 ),本研究发现红锥-马尾松混交林菌根际中AMF的比例明显少于EMF,菌根和根际中均存在较少ERMF。红锥-马尾松菌根际优势类群大多为EMF包括Russula、Lactarius、Amanita、Clavulinopsis、Inocybe、Clavulina,均为广布型非宿主专一性菌根菌,已在壳斗科(靳微等 2020)、桦木科(张彤彤等 2017)、松科(冀瑞卿等 2020)等林木菌根中发现。Russula为本研究区域中的绝对优势类群,且与红锥的共生能力更强。在自然状态和人工接种条件下,Russula能明显促进红锥、马尾松生长(周再知等 2011)。本研究亦发现Trichoderma属真菌在根际显著富集,该菌在生产上主要用于防治植物病原菌,可与菌根真菌协同促生。例如,宋小双等(2015)将褐环乳牛肝菌Suillus leutus与绿木霉Trichoderma virens复合接种,能有效提高红皮云杉Picea koraiensis促生抗逆能力。Sutarman et al.(2019) 发现EMF和哈茨木霉Trichoderma harzianum复合接种能显著增加丁香Syzygium aromaticum幼苗叶片数量,提高其根系侵染强度。
MHB能与菌根真菌协同作用促进菌根形成和宿主植物生长。红锥-马尾松混交林菌根际MHB除根际的Bacillus相对丰度远高于菌根外,Burkholderia、Pseudomonas、Bradyrhizobium、Rhizobium、Agrobacterium、Streptomyces、Ralstonia和Paenibacillus均能有效定殖于菌根,且Enterobacter只存在于菌根,这可能是菌根真菌与MHB间特异选择的结果,而这种伴随出现的菌根菌-细菌组合是维持混交林林分高质量发展的关键因子。已有大量研究工作报道指出MHB有助于菌根真菌在宿主根部的定殖,而菌根真菌分泌物亦能影响细菌组成。例如,荧光假单孢菌Pseudomonas fluorescens能有效促进双色蜡蘑Laccaria bicolor菌丝的生长和定殖,提高了L.bicolor在杨树Populus根系的侵染定殖(Labbéet al. 2014 ;Shinde et al. 2019 )。李守萍(2009)研究发现P.fluorescensHDY-20对褐黄牛肝菌Boletus luridus具有明显的促生作用,且两者对油松Pinus tabuliformis的双接种效应优于单接种。研究发现红锥和马尾松菌根部分膜运输通路(ABC transporters、transporters和secretion system)和信号转导通路(two-component system)的丰度高于根际,这可能与菌根中丰度较高的MHB类群有关。同时,细菌代谢功能也影响着菌根真菌的生长。Gao et al.(2017) 研究发现PTS通过促进营养利用和调节蜡状芽孢杆菌Bacillus cereus中sodA2的表达,影响其在小麦Triticum aestivum根际的定殖。
土壤中的N和P是决定菌根真菌发育和侵染的关键因子。本研究发现该混交林中优势固氮菌有Rhizobium、Bradyrhizobium和Agrobacterium,它们能将分子N转为有机N,改善植物的N营养,达到促生作用(Cocking2003);溶磷细菌主要有Pseudomonas、Bacillus、Rhizobium、Bradyrhizobium和Agrobacterium,它们通过释放有机酸来溶解无机磷或分泌胞外磷酸酶降解有机磷,从而提高宿主对P的有效吸收和利用(Kim 1997)。同时,菌根真菌会向菌丝际分泌各种代谢产物(主要包括糖类、有机酸类和氨基酸类等),菌丝会通过这些分泌物招募溶磷细菌在菌丝表面定殖,刺激其生长,提高其磷酸酶分泌能力,从而增强其解磷功能(Zhang et al. 2018 )。红锥-马尾松混交造林模式目前已经在我国华南地区大力推行,两者混交能明显提高林分生产力,这与该混交模式下菌根核心微生物(如Russula、Bradyrhizobium、Burkholderia等)密切相关。因此,研究EMF与细菌之间的共存关系,掌握它们之间的功能互补性,将有助于为研发优良复合菌剂应用于林木高效培育奠定基础。
微生物群落结构随生态系统中气候、土壤条件以及宿主植物生长状况变化而改变。本研究发现pH、TP和TK是影响红锥-马尾松混交林下优势菌群组成及分布的主要理化因子。红锥、马尾松根际土壤TP含量存在显著差异,可以认为TP是影响微生物分布的关键因子。本研究仅为5月份该混交林调查的结果,林木的根和根际具有高度特异性和丰富的微生物,而根系的季节性变化导致根和根际微生物群落存在季节性差异,未来仍需在不同季节的红锥、马尾松纯林和红锥-马尾松混交林中进行多样本调查分析,进一步揭示红锥-马尾松混交提高林分质量的微生态作用机制。
参考文献
454 Pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity
DOI:10.1111/nph.2009.184.issue-2 URL [本文引用: 1]
Effects of ectomycorrhizas and vesicular-arbuscular mycorrhizas, alone or in competition, on root colonization and growth of Eucalyptus globulus and E.urophylla
DOI:10.1046/j.1469-8137.2000.00663.x URL [本文引用: 1]
Endophytic colonization of plant roots by nitrogen-fixing bacteria
DOI:10.1023/A:1024106605806 URL [本文引用: 1]
Impacts of organic residue management on the soil C dynamics in a tropical eucalypt plantation on a nutrient-poor sandy soil after three rotations
DOI:10.1016/j.soilbio.2015.03.010 URL [本文引用: 1]
The phosphotransferase system gene ptsI in Bacillus cereus regulates expression of sodA2 and contributes to colonization of wheat roots
DOI:10.1016/j.resmic.2017.04.003 URL [本文引用: 1]
Role of bentonite on the mobility of antibiotic resistance genes, and microbial community in oxytetracycline and cadmium contaminated soil
An analysis of the growth and structure of mixed plantations consisted of Pinus massoninia and broadleaf species
Microbial community and associated enzymes activity influence soil carbon chemical composition inEucalyptus urophyllaplantation with mixing N2-fixing species in subtropical China
DOI:10.1007/s11104-016-3117-5 URL [本文引用: 1]
Correlation between ectomycorrhizal fungal community and environmental factors in Pinus koraiensisforest in Northeast China
Diversity of ectomycorrhizal fungi a seed collecting forest of Quercus virginiana
Effect of phosphate-solubilizing bacteria and vesicular- arbuscular mycorrhizae on tomato growth and soil microbial activity
DOI:10.1007/s003740050347 URL [本文引用: 1]
Newly identified helper bacteria stimulate ectomycorrhizal formation in Populus
Ectomycorrhizal fungal diversity in main community of Pinus massoniana in Guizhou
The inoculation effect of mycorrhiza helper Pseudomonas fluorescensand mycorrhizal fungi on host plant
Mycorrhizal interactions with the rhizosphere microflora: the mycorrhizosphere effect
Mycorrhizology
Investigation of the macrofungi of ectotrophic mycorrhiza of Pinus massoniana in Kaili City, Guizhou Province
Estimation of available phosphorus in soils by extraction with sodium bicarbonate
Allocation pattern of biomass and productivity for three plantations of Castanopsis hystrix, Pinus massoniana and their mixture in south subtropical area of Guangxi, China
The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms
DOI:10.1007/s11104-008-9568-6 URL [本文引用: 1]
Interaction between mycorrhizal fungi and rhizosphere microorganisms
Pseudomonas fluorescens increases mycorrhization and modulates expression of antifungal defense response genes in roots of aspen seedlings
DOI:10.1186/s12870-018-1610-0 URL [本文引用: 1]
Physiological response of Picea koraiensis Nakai seedlings to complex inoculation between Suillus leutus N94 and Trichoderma virens T43
Effect of ectomycorrhizal fungi and Trichoderma harzianum on the clove (Syzygium aromaticumL.) seedlings performances
How mycorrhizal associations drive plant population and community biology
Root exudates: from plant to rhizosphere and beyond
DOI:10.1007/s00299-019-02447-5 URL [本文引用: 1]
Signal beyond nutrient, fructose, exuded by an arbuscular mycorrhizal fungus triggers phytate mineralization by a phosphate solubilizing bacterium
Diversity of ectomycorrhizal fungi associated with Betula albosinensis in Xinjiashan forest region of Qinling Mountains
Screening study of mycorrhizal efficiently symbiosis of edible Russula fungus with host tree species
东北红松纯林菌根外生菌根真菌群落与环境因子的相关性
NY/T 85-1988
NY/T 53-1987
NY/T 88-1988
NY/T 87-1988
NY/T 889-2004