 PDF(836 KB)
PDF(836 KB)


 PDF(836 KB)
PDF(836 KB)
 PDF(836 KB)
PDF(836 KB)
丝状真菌次级代谢产物的功能与合成调控研究进展
 ({{custom_author.role_cn}}), {{javascript:window.custom_author_cn_index++;}}
({{custom_author.role_cn}}), {{javascript:window.custom_author_cn_index++;}}Research advance in functional and synthetic regulation of secondary metabolites of filamentous fungi
 ({{custom_author.role_en}}), {{javascript:window.custom_author_en_index++;}}
({{custom_author.role_en}}), {{javascript:window.custom_author_en_index++;}}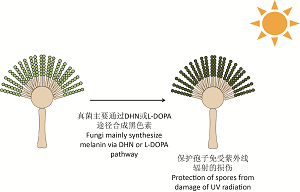
| {{custom_ref.label}} |
{{custom_citation.content}}
{{custom_citation.annotation}}
|
/
| 〈 |
|
〉 |