已知多种虫草类真菌都富含种类繁多的营养成分(氨基酸、维生素及微量元素等),亦含有丰富的虫草素、虫草酸、多糖、腺苷、麦角甾醇、次黄嘌呤及没食子酸等活性成分(戴玉成和杨祝良2008;Xu et al. 2016;Liu et al. 2018;Meng et al. 2019;Wu et al. 2019),在食品、保健品和生物医药等领域展现出广阔的应用前景。作为中国特有的种类和我国第二个虫草类新食品原料,广东虫草[Cordyceps guangdongensis T.H. Li, Q.Y. Lin & B. Song,即Tolypocladium guangdongense (T.H. Li, Q.Y. Lin & B. Song) V. Papp]子实体中检测到丰富的多糖、虫草酸和腺苷等活性成分,亦富含多种粗蛋白、维生素和微量元素等营养成分(林群英等2009b;崔红燕等2010)。小鼠实验结果表明:广东虫草子实体安全无毒,在改善慢性支气管炎、治疗慢性肾衰竭、抗流感病毒及抗疲劳等方面具有显著的功效(Yan et al. 2010,2013,2014)。因此,广东虫草是一种具有广阔应用前景、能够大规模栽培的经济真菌,具有重要的研究价值和科研意义。
在大型真菌原基形成和发育的过程中,温度是一个重要的限制因素,低温刺激促进了虎皮香菇Lentinus tigrins原基的形成(Lechner & Alberto 2007)。高温胁迫显著抑制香菇Lentinula edodes (Berk.)、糙皮侧耳Pleurotus ostreatus (Jacq.) P. Kumm.、双孢蘑菇Agaricus bisporus (J.E. Lange) Imbach等多种食药用真菌菌丝体生长、原基形成、子实体生长和品质(Lu et al. 2014;曹现涛等2015;Qiu et al. 2018),进而造成经济损失。在本研究团队前期研究中,发现环境温度高于25℃时,广东虫草无法正常形成原基;在20-25℃培养条件下,广东虫草子实体生长正常,23℃子实体生长最好;28℃子实体生长受到抑制。研究结果表明,广东虫草栽培过程中,高温显著影响原基的形成、降低子实体的产量和质量。本研究进一步系统地探索温度对广东虫草菌丝体生长和原基形成的影响,从组学层面解析高温影响广东虫草原基形成的调控网络。
Zhang et al.(2018)进行了广东虫草基因组测序和注释,并对不同发育时期的菌丝体和子实体样品进行了较为系统的转录组、蛋白组、代谢产物及micro-like RNAs差异分析(Wang et al. 2020a,2021)。本研究系统地分析了不同温度对广东虫草菌丝体生长和原基形成的影响,筛选了高温抑制广东虫草原基形成的处理时间点,对不同处理后的菌丝体和原基进行转录组测序,并对差异表达基因进行GO功能注释和KEGG代谢通路分析。同时,分析了碳水化合物代谢相关基因、热激蛋白、C2H2等基因的差异表达,揭示了高温抑制广东虫草原基形成的调控网络,从基因改造层面培育出抗逆性强、易形成原基的新品种。
1 材料与方法
1.1 供试菌株
广东虫草T. guangdongense菌株(GDGM30035)保藏于广东省微生物研究所华南微生物资源中心。
1.2 不同温度对广东虫草菌丝生长和原基形成的影响
1.2.1 不同温度对广东虫草菌丝生长的影响:将生长14d的广东虫草菌丝块(直径6mm)接种于PDA(土豆200g,葡萄糖20g,琼脂20g,1L ddH2O)固体培养基上,置于不同温度梯度(12、17、23、29和32℃),黑暗条件下培养25d,十字法测菌落直径。
1.2.2 不同温度对广东虫草原基形成的影响:将生长14d的广东虫草菌丝块(直径6mm)接种于PD(土豆200g,葡萄糖20g,1L ddH2O)液体培养基中,23℃、120r/min培养10d。将一个广东虫草菌丝球接种在PDA培养基上,23℃黑暗条件下培养20d,400-500Lx光照3d,置于17、23和29℃处理1、2、3和4d,再放置于23℃和400-500Lx诱导原基形成并观察原基形成情况;将多个广东虫草菌丝球接种在大米培养基(林群英等2009a)和PDA培养基上,23℃黑暗条件下培养10d,400-500Lx光照3d,放置于17、23和29℃处理3d,再放置于23℃和400-500Lx诱导原基形成并观察原基形成情况。
1.3 样品收集
基于前文的筛选结果,选取29℃为高温胁迫处理温度,实验步骤参照1.2.2。不同温度处理前,收集菌丝样品(对照组CK);不同温度处理3d,收集23℃(CK-3d)和29℃(HT-3d)培养条件下菌丝样品;对照组原基形成时,收集23℃(CK-P)和29℃(HT-P)培养条件下原基或菌丝样品。样品收集后,立即用液氮进行冷冻,并放置-80℃保存。
1.4 RNA提取、cDNA文库构建及测序
取0.1g广东虫草菌丝或原基样品,加入含适量液氮的研钵中研磨成粉末;将粉末转移至1.5mL液氮冷冻离心管,加入1mL TRIzol试剂(Invitrogen)进行RNA提取,详细操作步骤参照试剂说明书。1%琼脂糖电泳用于检测获得RNA的完整性,并采用Agilent 2100生物分析仪和NanoDrop仪对获得的RNA进行质量检测。完整性好且RIN值大于7.5的样品,进行后续文库的构建。文库构建成功后,于华大基因的Illumina HiSeq2000平台进行测序。
1.5 转录组数据处理、差异基因功能注释及代谢途径分析
采用filter-fq软件对原始数据进行过滤,去除带接头、未知碱基含量比例大于5%和低质量的序列(reads),获得有效序列(clean reads),并利用HISAT v 2.1.0软件将获得的clean reads匹配到广东虫草参考基因组(Kim et al. 2015)。用featureCounts v1.6.2对基因比对情况进行计算(Yang et al. 2014),再根据基因长度计算每个基因的FPKM(fragment per kb per million fragments)。利用DESeq2 v1.22.1进行两组之间的差异表达分析,并采用 Benjamini & Hochberg方法校正P值(Love et al. 2014)。校正后的P值(<0.05)及|log2 (fold change)|≤1作为显著差异表达的阈值。差异基因gene ontology(GO)分析在
1.6 数据统计分析
每个处理有15个生物学重复,所有试验数据用“平均值±标准差”来表示,采用SPSS20.0软件对试验数据进行差异分析,以P<0.05为差异显著性的评判标准。
2 结果与分析
2.1 不同温度影响广东虫草菌丝生长的差异分析
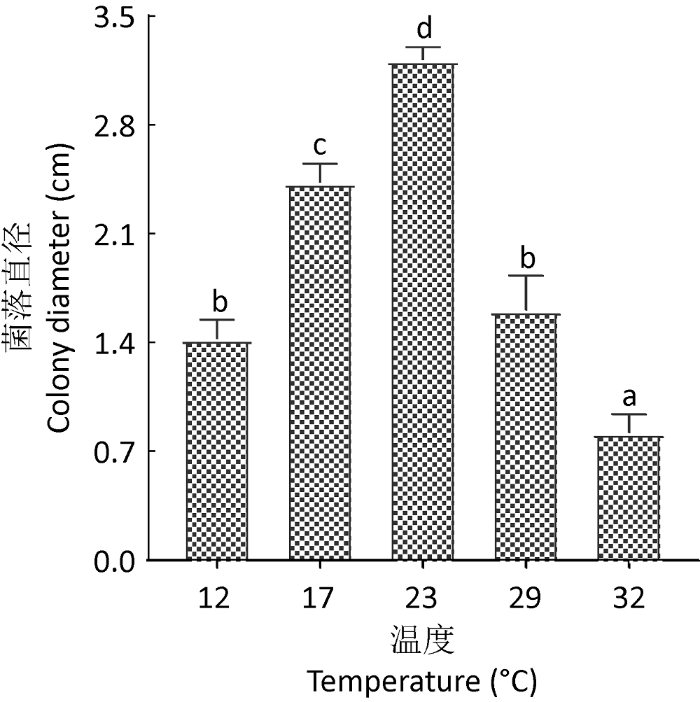
在不同温度条件下培养25d,广东虫草菌落直径大小展现出显著差异(图1)。其中,23℃培养条件下菌落直径最大,为(3.22±0.08)cm,32℃培养条件下菌落直径最小,为(0.82±0.12)cm,12℃和29℃培养条件下菌落直径没有显著性差异,而与其他3个温度条件下具有显著的差异;于菌丝生长速率而言,23℃条件下菌丝生长最快(约0.05cm/d),32℃条件下菌丝生长最慢(约0.004cm/d),不同温度条件下菌丝生长速率均表现出显著性差异。基于上述结果,23℃是广东虫草菌丝生长的最适温度。
图1
图1
不同温度条件下广东虫草菌丝生长速度分析
小写字母,显著差异(P<0.05)
Fig. 1
Analysis of mycelial growth indexes in Cordyceps guangdongensis under different temperatures.
Lowercase letters, significant difference (P<0.05).
2.2 不同温度影响广东虫草原基形成情况的分析
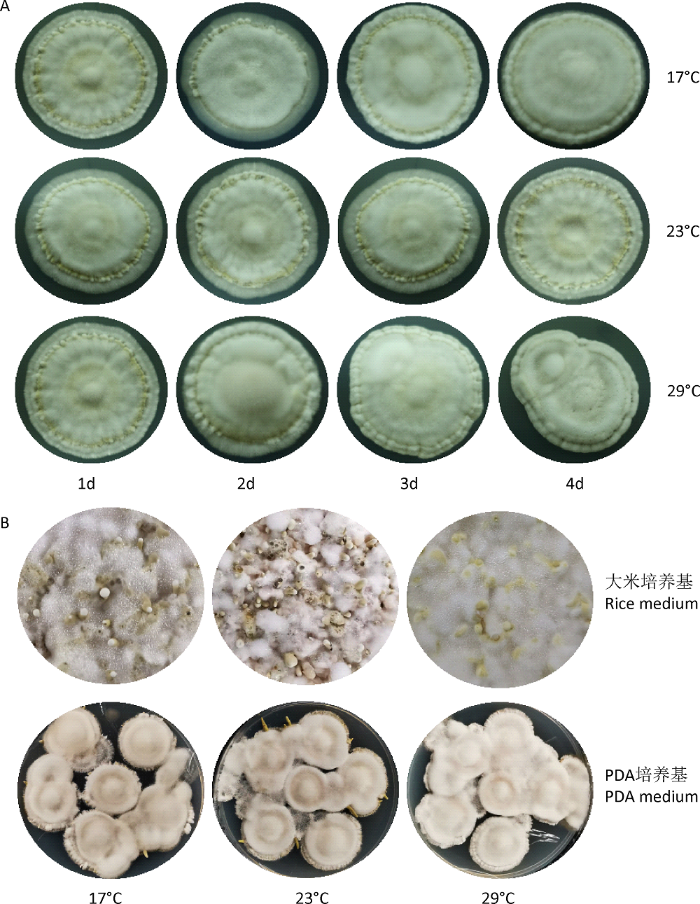
根据不同温度影响广东虫草菌丝生长分析结果,选取17℃和29℃作为低温胁迫和高温胁迫的温度。在PDA培养基上(图2A),17℃和29℃处理1d,原基形成情况和对照(23℃)无明显差异,处理2d,原基的形成受到明显的影响;处理3d,17℃处理组有少量原基形成,而29℃处理组则没有原基形成;处理4d,17℃和29℃处理都没有原基形成。基于上述结果,在大米培养基和PDA培养基上,选取17℃和29℃处理3d,进一步观察温度对原基形成的影响。在大米培养基上,17℃和29℃明显减少了原基的数量;在PDA培养基上,17℃处理组能够形成少于对照组数量的原基和幼嫩子实体,而29℃处理组无原基形成(图2B)。所以,选取29℃处理3d作为后续样品收集的处理温度和时间节点。
图2
图2
不同温度胁迫对广东虫草原基形成的影响
A:在PDA培养基上17℃、23℃和29℃处理不同时间后原基的形成情况;B:在不同培养基上17℃、23℃和29℃处理3d后原基的形成情况
Fig. 2
Effects of different temperature stresses on primordial formation of Cordyceps guangdongensis.
A: Primordial formation of C. guangdongensis on PDA medium after different periods of 17°C, 23°C and 29°C treatment; B: Primordial formation of C. guangdongensis on different media after 3d treatment under 17°C, 23°C and 29°C.
2.3 转录组数据分析
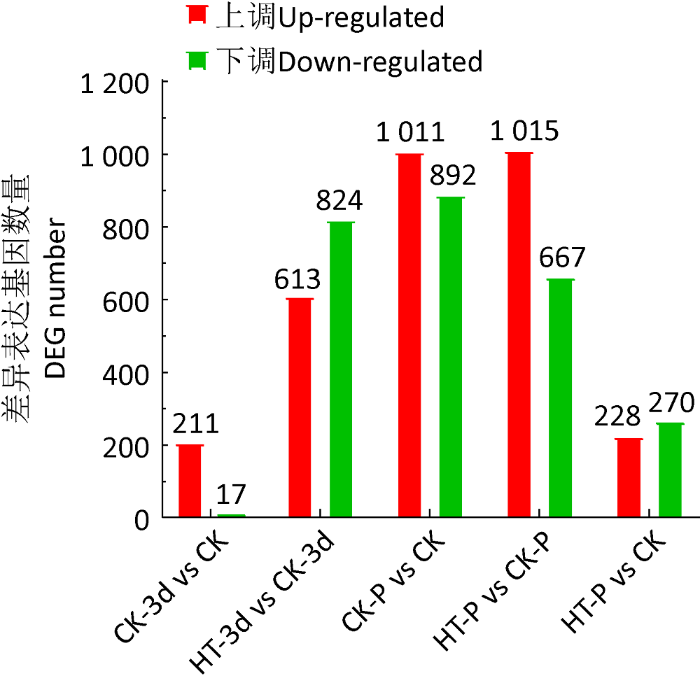
5组处理构建15个cDNA文库,共得到416 644 470个有效序列,CK组、CK-3d组、HT-3d组、CK-P组和HT-P组分别有83 273 038、83 524 576、83 121 514、83 879 476和82 845 866个有效序列;Q30大于88.31%,与广东虫草基因组的匹配率大于95.82%。CK-P组和CK组有最多的差异表达基因(1 903个),上调表达基因1 011个,下调表达基因892个;其次是HT-P组和CK-P组,有1 682个差异表达基因(1 015个上调表达和667个下调表达);HT-3d组和CK-3d组有1 437个差异表达基因,其中613个上调表达基因和824个下调表达基因;而CK-3d组和CK组具有最少的差异表达基因(228个),上调表达基因211个,下调表达基因17个(图3)。
图3
图3
不同处理间差异表达基因数量统计
Fig. 3
Statistics of DEG numbers between different treatments.
CK: Mycelium before treatment; CK-3d: Mycelium under 23°C; HT-3d: Mycelium under 29°C; CK-P: Primordium under 23°C; HT-P: Primordium under 29°C. The same below.
2.4 差异表达基因功能注释
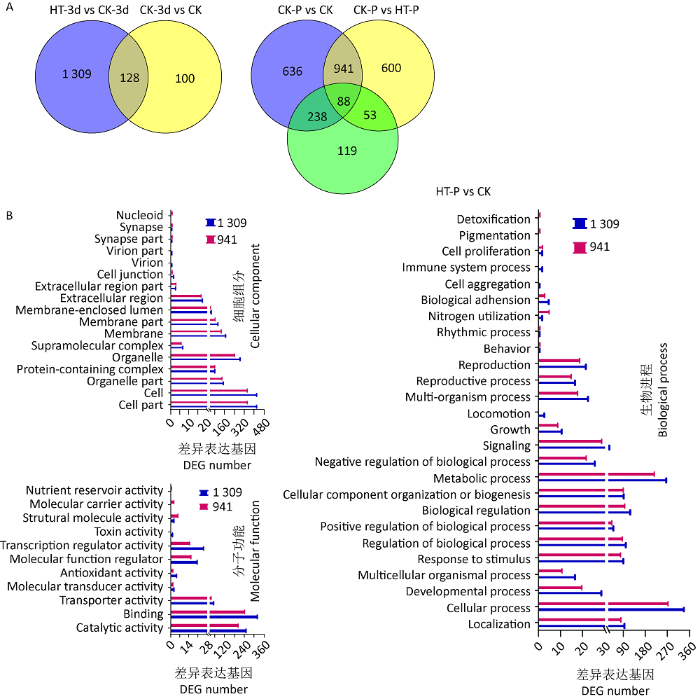
通过不同处理之间综合比较分析,发现有1 309个差异表达基因响应高温胁迫,941个差异表达基因参与高温抑制原基形成的调控(图4A)。分别对1 309和941个差异表达基因进行GO注释分析(图4B):细胞组分方面,多数差异表达基因涉及细胞、细胞器、细胞膜等;分子功能层面,多数差异表达基因参与结合活性、催化活性、转运活性等,毒素活性是响应高温胁迫的差异表达基因涉及的特有分子功能,而高温抑制原基形成的相关差异表达基因涉及分子运载体和营养储存体活性;生物进程方面,多数差异表达基因涉及细胞过程、代谢过程、生物调控、定位、细胞组分结构或生物起源、刺激响应等,毒素活性响应高温胁迫的差异表达基因涉及的特有分子功能包括迁移和免疫系统进程,而高温抑制原基形成的相关差异表达基因涉及解毒和色素沉积进程。KEGG富集分析发现,响应高温胁迫的差异表达基因富集到RNA降解、MAPK信号途径、磷酸肌醇代谢、抗原加工和呈递等代谢途径,而高温抑制原基形成的相关差异表达基因富集到内吞作用、抗原加工和呈递等代谢途径。
图4
图4
不同处理间差异表达基因GO注释分析
A:高温处理及原基形成前后差异表达基因韦恩图;B:高温处理及原基形成前后差异表达基因GO注释
Fig. 4
Statistics of DEG numbers between different treatments.
A: Venn maps showing the overlaps of DEGs after high temperature and primordial formation; B: GO annotation of DEGs after high temperature treatment and primordial formation.
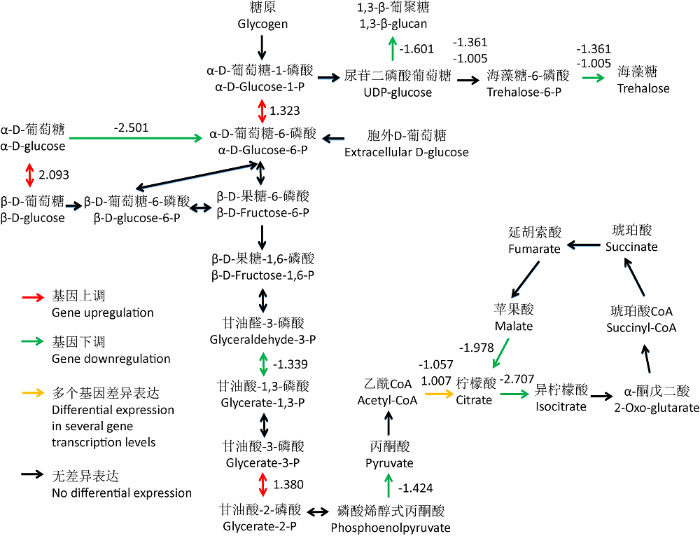
2.5 碳水化合物代谢途径分析
基于广东虫草基因组、转录组注释和KEGG代谢途径分析,构建了广东虫草热胁迫影响原基形成过程中的碳水化合物代谢途径(图5)。在糖类转运蛋白作用下,葡萄糖被运输至细胞内进行糖酵解,终产物丙酮酸于线粒体中形成乙酰 CoA,然后进行三羧酸循环产生能量。在糖酵解和三羧酸循环的过程中,注释到41个相关基因。HT-P组和CK-P组相比,9个基因显著下调表达,4个基因明显上调表达。糖酵解途径中,3-磷酸-甘油醛脱氢酶和丙酮酸激酶相关基因转录水平显著下调;在三羧酸循环过程中,乌头酸水合酶和苹果酸脱氢酶基因转录水平显著下调。推测高温影响广东虫草菌丝体糖酵解和三羧酸循环代谢,产生的能量减少,进而影响广东虫草原基的形成。此外,葡聚糖合成相关基因(1,3-β-葡聚糖合酶)及海藻糖合成相关基因(6-磷酸海藻糖合酶和6-磷酸海藻糖磷酸酶)转录水平显著下调,表明葡聚糖和海藻糖的合成减少,进一步影响广东虫草菌丝体的抗逆能力和原基的形成。
图5
图5
高温胁迫影响广东虫草原基形成过程中碳水化合物代谢途径
数值=log2(FPKMHT-P/FPKMNT-P);红色数据为基因上调;绿色数据为基因下调
Fig. 5
Carbohydrate metabolism pathway during the process of high temperature stress affecting the primordial formation of Cordyceps guangdongensis.
2.6 高温影响原基形成过程中热激蛋白和C2H2锌指转录因子转录水平变化
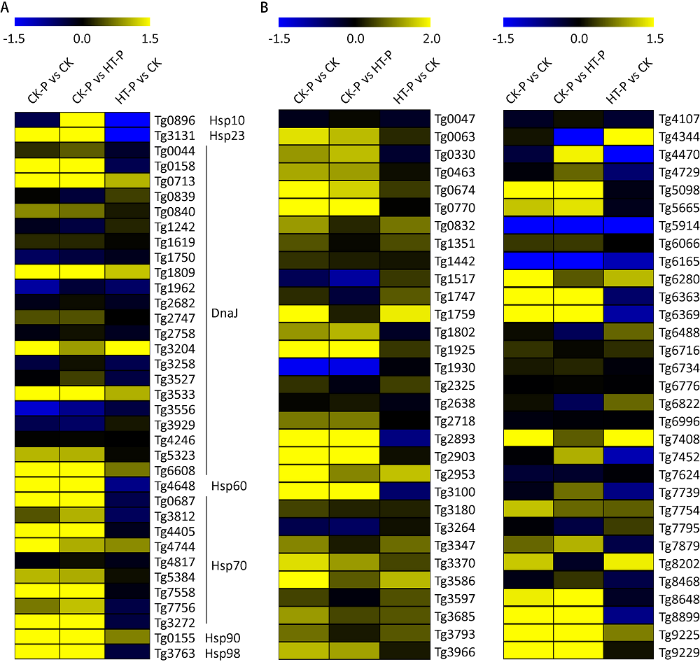
基于广东虫草基因组注释结果,鉴定到36个编码热激蛋白相关基因,其中,22个DnaJ家族基因、9个Hsp70家族基因、2个Hsp90家族基因及Hsp60、Hsp23和Hsp10各1个。与CK组或CK-P相比,Hsp10和Hsp23在HT-P组都显著下调表达,而Hsp23在CK-P组显著上调表达(图6A)。22个DnaJ家族基因中,与CK组相比,3个基因(Tg0713、Tg1809和Tg3533)在CK-P组和HT-P组显著上调表达,且在CK-P组上调幅度最大,Tg3204在CK-P组和HT-P组显著上调表达,而在CK-P组和HT-P组之间没有显著差异表达;3个基因(Tg0158、Tg5323和Tg6608)在CK-P组显著上调表达,而在HT-P组转录水平没有显著变化;Tg3556的转录水平明显下调。8个Hsp70家族基因中,与CK组相比,5个基因在CK-P组和HT-P组显著上调表达,且在CK-P组上调水平更显著;Tg3812和Tg7756仅在CK-P组和HT-P组出现明显上调表达。与CK组相比,Hsp60、Hsp90和Hsp98转录水平在CK-P组和HT-P组显著上调表达,且在CK-P组具有更显著的上调表达。上述结果表明,在高温影响原基形成的过程中,Hsp10、Hsp23、Hsp60、Hsp90、Hsp98、4个DnaJ家族和7个Hsp70家族基因转录水平显著降低(图6A),推断可能通过减弱分子伴侣功能和降低维持其他蛋白结构的能力,热激蛋白参与高温抑制原基形成的调控。
图6
图6
高温胁迫影响广东虫草原基形成过程热激蛋白(A)和C2H2转录因子(B)基因差异表达热图
Fig. 6
Heatmap showing the differential expression levels of genes encoding heat shock proteins (A) and transcription factors C2H2 (B) during the process of high temperature inhibiting the primordial formation.
根据广东虫草基因组注释结果,鉴定到62个编码C2H2转录因子基因。与CK组相比,Tg2953在CK-P组和HT-P组显著上调表达,且在CK-P组表达量最高;Tg5914和Tg6165在CK-P组和HT-P组显著下调表达,且在CK-P组下调程度更显著;20个C2H2基因仅在CK-P组显著上调表达,并且转录水平显著高于HT-P组的转录水平(图6B)。在CK-P组和HT-P组中,5个基因(Tg1759、Tg3586、Tg6280、Tg7408和Tg8202)的转录水平比CK组显著上调,且CK-P组和HT-P组中没有显著差异表达。此外,CK-P组中Tg0832、Tg3347、Tg3685和Tg7754转录水平仅显著高于CK组转录水平,与HT-P组转录水平没有显著差异表达;CK-P组Tg4470、Tg7452和Tg7879转录水平显著高于HT-P组转录水平。基于基因差异表达结果,在高温影响原基形成的过程中,24个C2H2基因在CK-P组显著上调表达,4个C2H2基因在CK-P组显著下调表达(图6B),推测锌指转录因子C2H2可能通过调控下游基因的表达,以参与高温抑制原基形成的调控。
2.7 高温影响原基形成过程中氧化还原和信号传导相关基因差异分析
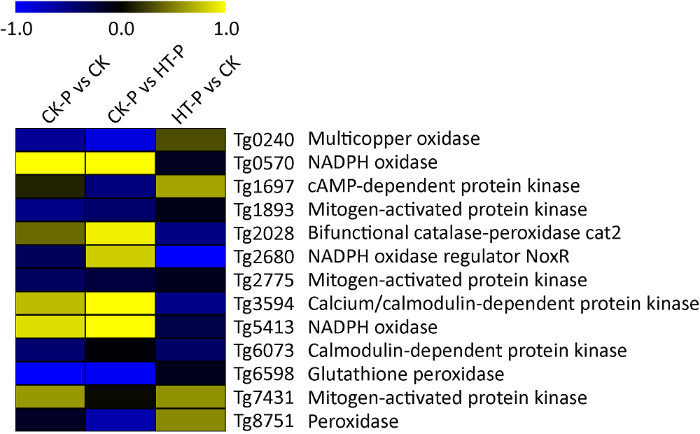
根据广东虫草基因组注释结果,发现7个氧化还原相关基因、3个信号传导相关基因和3个MAPK蛋白激酶相关基因。与CK组及HT-P组对比,NADPH氧化酶基因Tg0570在CK-P组显著上调表达;与HT-P组相比,NADPH氧化酶基因Tg5413和钙-钙调素依赖性蛋白激酶基因Tg3954在CK-P组转录水平显著上调;与CK组相比,谷胱甘肽过氧化物酶基因Tg3954在CK-P组明显下调。此外,与CK组比,编码NADPH氧化酶调节子基因Tg2680在HT-P组转录水平显著下调,而与CK-P组中该基因的转录水平没有明显差异表达(图7)。因此,推断NADPH氧化酶基因Tg0570和Tg5413及钙调素依赖性蛋白激酶基因Tg3954可能参与高温抑制原基形成过程的调控。
图7
图7
高温胁迫影响广东虫草原基形成过程氧化还原和信号传导相关基因差异表达热图
Fig. 7
Heatmap showing the differential expression levels of genes involved in oxidoreduction and signal transduction during the process of high temperature inhibiting the primordial formation.
3 讨论
在双孢蘑菇栽培过程中,高温明显减缓子实体的生长,子实体变小、变黄,严重影响其产量和质量(Lu et al. 2014)。本研究发现,17℃以下低温和29℃以上高温显著抑制了广东虫草原基的形成,17℃低温处理3d减少了广东虫草原基的形成,29℃处理3d显著抑制了广东虫草原基的形成。葡聚糖和海藻糖在食用菌的抗逆性、细胞稳定方面起到了关键的作用(Manzi & Pizzoferrato 2000;刘秀明等2013)。在碳水化合物代谢途径中,多个糖酵解、三羧酸循环及葡聚糖和海藻糖合成相关基因在高温处理后呈现下调表达,表明高温胁迫影响了广东虫草菌丝体的细胞稳定性和抗逆性,减少了葡聚糖和海藻糖的合成,进而抑制了原基的形成。
热激蛋白通过与其他蛋白互作或者稳定其他蛋白的结构活性,在生物生长发育、抗逆等多种生物过程中起到重要的作用。沉默香菇热激蛋白基因40 DnaJ后,突变体菌丝生长速度显著减慢、抗深绿木霉Trichoderma atroviride和热胁迫能力明显变弱(Wang et al. 2018),而该基因超量表达后,突变体菌丝生长速度变快和菌丝体耐热能力增强(Wang et al. 2020b)。本研究结果中,原基中的多个热激蛋白基因(Hsp10、Hsp23、DnaJ、Hsp70、Hsp90he Hsp98)转录水平显著上调表达,而在高温处理3d同时期的菌丝体中这些基因显著下调表达。由此推测,多个热激蛋白基因可能通过互作或稳定功能蛋白结构,保证高温处理过程中重要蛋白的功能活性,从而减弱高温胁迫引起的损伤,参与高温调控原基形成的过程。在裂褶菌Schizophyllum commune中,转录因子C2H2失活菌株的菌丝体能够扭结,但不能形成原基和子实体(Ohm et al. 2011);C2H2超量表达的双孢蘑菇突变株菌盖生长速度、子实体总数量和生物量没有显著变化,而单天产量最大值提前了1d(Pelkmans et al. 2016),表明转录因子C2H2参与了大型真菌原基的形成和子实体的生长发育。本研究结果表明,与高温处理3d后原基同时期的菌丝体样品相比,24个C2H2基因显著上调表达,4个C2H2基因显著下调表达。由此推测转录因子C2H2可能通过调控下游基因的表达,参与高温影响原基形成的调控过程。
本研究旨在通过测定不同温度对广东虫草菌丝体生长和原基形成的影响,明确温度影响广东虫草原基形成的关键点;对高温处理前后的菌丝体和原基进行转录组测序,分析高温影响原基形成的分子调控网络。但具体的调控途径和机制尚不明确,在高温影响广东虫草原基形成的过程中,热激蛋白和转录因子C2H2的具体功能等可以采用基因沉默、超量表达、基因编辑等手段进行深入的研究。
参考文献
Effect of heat stress on Lentinula edodes mycelial growth recovery and resistance to Trichoderma harzianum
GC-MS analysis of fatty acids from Cordyceps guangdongensis
A revised checklist of medicinal fungi in China
HISAT: a fast spliced aligner with low memory requirements
DOI:10.1038/NMETH.3317
[本文引用: 1]

Kim, Daehwan; Langmead, Ben; Salzberg, Steven L. Johns Hopkins Univ, Sch Med, Ctr Computat Biol, McKusick Nathans Inst Genet Med, Baltimore, MD 21205 USA. Kim, Daehwan Johns Hopkins Univ, Dept Biostat, Bloomberg Sch Publ Hlth, Baltimore, MD 21205 USA. Langmead, Ben; Salzberg, Steven L. Johns Hopkins Univ, Dept Comp Sci, Baltimore, MD 21218 USA.
Optimal conditions for the fruit body production of natural occurring strains of Lentinus tigrinus
DOI:10.1016/j.biortech.2005.07.036 URL [本文引用: 1]
Studies on light and temperature conditions for cultivation of Cordyceps guangdongensis
Comparison of selected chemical component levels in Cordyceps guangdongensis, C. sinensis and C. militaris
Fermenting liquid vinegar with higher taste, flavor and healthy value by using discarded Cordyceps militaris solid culture medium
DOI:10.1016/j.lwt.2018.07.064 URL [本文引用: 1]
Alleviative effects of exogenous trehalose on oxidative damage metabolism in Pleurotus pulmonarius under heat stress
Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2
DOI:10.1186/s13059-014-0550-8 URL [本文引用: 1]
Para-aminobenzoic acid (paba) synthase enhances thermotolerance of mushroom Agaricus bisporus
DOI:10.1371/journal.pone.0091298 URL [本文引用: 2]
Beta-glucans in edible mushrooms
DOI:10.1016/S0308-8146(99)00197-1 URL [本文引用: 1]
Determination and quantitative comparison of nucleosides in two Cordyceps by HPLC-ESI-MS-MS
DOI:10.1093/chromsci/bmz012 URL [本文引用: 1]
Transcription factor genes of Schizophyllum commune involved in regulation of mushroom formation
DOI:10.1111/j.1365-2958.2011.07776.x URL [本文引用: 1]
The transcriptional regulator c2h2 accelerates mushroom formation in Agaricus bisporus
DOI:10.1007/s00253-016-7574-9
PMID:27207144
[本文引用: 1]

The Cys2His2 zinc finger protein gene c2h2 of Schizophyllum commune is involved in mushroom formation. Its inactivation results in a strain that is arrested at the stage of aggregate formation. In this study, the c2h2 orthologue of Agaricus bisporus was over-expressed in this white button mushroom forming basidiomycete using Agrobacterium-mediated transformation. Morphology, cap expansion rate, and total number and biomass of mushrooms were not affected by over-expression of c2h2. However, yield per day of the c2h2 over-expression strains peaked 1 day earlier. These data and expression analysis indicate that C2H2 impacts timing of mushroom formation at an early stage of development, making its encoding gene a target for breeding of commercial mushroom strains.
High- temperature induced changes of extracellular metabolites in Pleurotus ostreatus and their positive effects on the growth of Trichoderma asperellum
DOI:10.3389/fmicb.2018.00010 URL [本文引用: 1]
Differential expression in RNA-Seq: a matter of depth
DOI:10.1101/gr.124321.111
PMID:21903743
[本文引用: 1]

Next-generation sequencing (NGS) technologies are revolutionizing genome research, and in particular, their application to transcriptomics (RNA-seq) is increasingly being used for gene expression profiling as a replacement for microarrays. However, the properties of RNA-seq data have not been yet fully established, and additional research is needed for understanding how these data respond to differential expression analysis. In this work, we set out to gain insights into the characteristics of RNA-seq data analysis by studying an important parameter of this technology: the sequencing depth. We have analyzed how sequencing depth affects the detection of transcripts and their identification as differentially expressed, looking at aspects such as transcript biotype, length, expression level, and fold-change. We have evaluated different algorithms available for the analysis of RNA-seq and proposed a novel approach--NOISeq--that differs from existing methods in that it is data-adaptive and nonparametric. Our results reveal that most existing methodologies suffer from a strong dependency on sequencing depth for their differential expression calls and that this results in a considerable number of false positives that increases as the number of reads grows. In contrast, our proposed method models the noise distribution from the actual data, can therefore better adapt to the size of the data set, and is more effective in controlling the rate of false discoveries. This work discusses the true potential of RNA-seq for studying regulation at low expression ranges, the noise within RNA-seq data, and the issue of replication.
Transcriptome and proteome analyses reveal the regulatory networks and metabolite biosynthesis pathways during the development of Tolypocladium guangdongense
DOI:10.1016/j.csbj.2020.07.014 URL [本文引用: 1]
Identification of microRNA-like RNAs in Cordyceps guangdongensis and their expression profile under differential developmental stages
DOI:10.1016/j.fgb.2020.103505 URL [本文引用: 1]
Hsp40 protein LeDnaJ07 enhances the thermotolerance of Lentinula edodes and regulates IAA biosynthesis by interacting LetrpE
DOI:10.3389/fmicb.2020.00707 URL [本文引用: 1]
The heat shock protein 40 LeDnaJ regulates stress resistance and indole-3-acetic acid biosynthesis in Lentinula edodes
Resource diversity of Chinese macrofungi: edible, medicinal and poisonous species
DOI:10.1007/s13225-019-00432-7 URL [本文引用: 1]
The mechanisms of pharmacological activities of Ophiocordyceps sinensis fungi
DOI:10.1002/ptr.v30.10 URL [本文引用: 1]
Anti-fatigue property of Cordyceps guangdongensis and the underlying mechanisms
DOI:10.3109/13880209.2012.760103 URL [本文引用: 1]
Safety assessment of Cordyceps guangdongensis, 2010
DOI:10.1016/j.fct.2010.08.001 URL [本文引用: 1]
Anti-inflammatory effect of a novel food Cordyceps guangdongensis on experimental rats with chronic bronchitis induced by tobacco smoking
FeatureCounts: an efficient general purpose program for assigning sequence reads to genomic features
Whole genome sequence of an edible and potential medicinal fungus, Cordyceps guangdongensis