蛹虫草又名北虫草,在我国广东、湖南、上海、江苏、河北、山东、吉林等省市均有大规模种植,其所含的虫草素、腺苷、多糖等活性物质具有抗肿瘤、抗病毒、抗氧化、提高免疫力等作用(Jiang et al. 2011;Bizarro et al. 2015;Liu et al. 2016;Wu et al. 2019)。蛹虫草在2009年被批准为新资源食品后,越来越多的蛹虫草产品被开发,包括以蛹虫草为原料的保健食品和普通食品。据估计蛹虫草产业年产值达100亿元人民币(董彩虹等 2016)。蛹虫草品质的差异受菌种、培养基、栽培方式、采收时间等多种因素影响(郭涛等2011;施新琴等2015;蒲彬等2016;Zhu et al. 2019)。目前人工栽培的蛹虫草子实体主要通过以大米、小麦等培养基培养或蚕蛹接种培养获得(吴鸿雪等2019)。目前市场上蛹虫草的活性成分差异巨大,虫草素的含量差异最大,可相差14倍,其次N6-(2-羟乙基)腺苷含量可相差6倍(朱丽娜等 2018)。精品缺乏等问题困扰着产业的发展。将蛹虫草菌株接种于昆虫活体进行仿生培养,得到的蛹虫草中活性成分含量相对较高。蒲彬等(2016)研究表明,与混合配料培养基上(小麦、大米、蚕蛹粉混合)培养的子实体相比,蛹虫草接种于蚕蛹活体上所得子实体的腺苷含量增加80.39%、氨基酸含量增加30.31%、必需氨基酸含量增加47.42%,混合培养基处理的多糖含量高于蚕蛹活体接种的处理,两个处理间的虫草素含量差别不大。然而,蚕蛹活体接种产出效率低、成本高、受蚕蛹生长季节的影响以及技术要求,与之相较,人工固体培养技术的成本低于昆虫活体人工培养技术,其风险更小,可行性更高。本研究以前期选育出的蛹虫草优良菌株为材料,探讨不同栽培方式、不同培养基及培养基中添加蚕蛹粉对蛹虫草子实体活性成分的影响,以期为生产高品质的蛹虫草原料及蛹虫草中活性物质的开发利用提供参考。
1 材料与方法
1.1 实验材料
1.1.1 蛹虫草菌株和培养基原料:蛹虫草菌株由上海市农业科学院生态环境保护研究所虫草课题组提供(通过上海市新品种认定,品种名为“沪丰1号”蛹虫草)。大米、小麦、柞蚕蛹由沈阳农业科学院提供。
1.1.2 试剂:半乳糖(Gal)、葡萄糖(Glc)、阿拉伯糖(Ara)、岩藻糖(Fuc)、鼠李糖(Rha)、甘露糖(Man)、木糖(Xyl)、葡萄糖醛酸(GluA)、半乳糖醛酸(GalA)、赤藓糖醇(erythritol)、甘露醇(manitol)、海藻糖(trehalose)、黄嘌呤(Xan)、胞嘧啶(Cyt)、胞苷(cytidine)、腺嘌呤(adenine)、腺苷(adenosine)、鸟苷(guanosine)、次黄嘌呤(hypoxanthine)、尿嘧啶(uracil)、尿苷(uridine)、胸腺嘧啶(thymine)、虫草素(cordycepin)、肌苷(inosine)、胸苷(thymidine)购自美国Sigma公司;普鲁兰多糖标准品(P-82)购自日本Shodex公司;2’-脱氧鸟苷(2’-deoxyguanosine)和2’-脱氧腺苷(2’-deoxyadenosine)购自上海生工生物工程有限公司;N6-(2-羟乙基)腺苷[N6-(2-hydroxyethyl) adenosine,HEA]由本研究所在研究室分离纯化;甲醇购自美国Dikma公司(色谱纯);DMSO购自上海朝瑞生物科技有限公司(分析纯);50%氢氧化钠溶液购自德国Merck公司;浓硫酸、无水乙醇、苯酚、硝酸钠、磷酸二氢钠等为国药集团化学试剂有限公司产品(分析纯)。
1.1.3 主要仪器:HPSEC-MALLS-RI联用系统:2695高效液相色谱(Waters,USA)、2414示差折光检测器、DAWN 8+激光检测器(Wyatt,USA)。1525高效液相色谱、2489UV检测器及2707自动进样器(Waters,USA)。ICS-2500离子色谱仪(Dionex,USA)。Q-600B超声清洗器(昆山市超声仪器有限公司);PURELAB ULTRA纯水制备仪(Elga,UK);FA2004N分析天平(上海精密科学仪器有限公司);J-02小型粉碎机(上海淀久中药机械制造有限公司);5415D高速离心机(Eppendorf,GER)。
1.1.4 培养基:配料栽培所用培养基干料组成:(1)培养基W:100%麦粒;(2)培养基WW:90%麦粒加10%蚕蛹粉;(3)培养基R:100%大米;(4)培养基RW:90%大米加10%蚕蛹粉。活体蚕蛹栽培方式中,采用新鲜活体柞蚕蛹,以针刺方式活体接种后生产蛹虫草子实体。
1.2 蛹虫草培育
1.2.1 菌种制备:菌株在PDA培养基上25℃培养7d,取4块0.5cm×0.5cm菌丝块接于装有100mL PDB培养基的250mL三角瓶中,150r/min 25℃培养5d,制成液体菌种。
1.2.2 子实体培育:(1)将培养基装入培养瓶(直径6.8cm,高10.5cm),每瓶装20g干料,加入33mL蒸馏水,121℃灭菌25min,等灭菌的培养基冷却至室温后接入液体菌种,每瓶接种2mL。为保证透气和避免空气交换产生污染,先用滤纸垫于瓶盖中,将培养瓶置于25℃黑暗条件下培养3-4d,直至培养基表面的菌丝开始蔓延,然后将培养瓶转至培养室进行光培养,培养温度22℃,光照强度约为500lx,培养约17d后出现原基,45d后子实体长满全瓶时采收。(2)取新鲜活体柞蚕蛹,经75%酒精表面消毒后,在超净台上每个蚕蛹接种1mL液体菌种,置于无菌培养瓶中(直径6.8cm,高10.5cm)培养,每瓶5个,培养过程和条件与(1)同步,每个处理19瓶。采收的子实体在60℃烘至恒重后粉碎。
1.3 多糖测定
蛹虫草多糖提取及测定采用薛俊杰等(2012)的方法。单糖组成测定参考Zhou et al.(2012)的离子色谱法。多糖的分子量分布测定参考朱丽娜等(2017)的HPSEC- MALLS-RI系统联用法。每个样品2次重复。
1.4 核苷测定
用HPLC测定样品中核苷类成分(朱丽娜等2018),每样品重复3次。
1.5 游离糖醇及小分子糖类成分测定
样品中海藻糖、甘露醇及小分子糖类成分的测定采用高效阴离子色谱法(朱丽娜等 2017),每样品重复3次。
1.6 子实体品质综合评价
对各成分含量的数据归一化处理,然后进行蛹虫草子实体品质综合评价(朱丽娜等 2018)。
2 结果与分析
2.1 多糖的比较
2.1.1 多糖含量和单糖组成:同一蛹虫草菌株接种于麦粒(W)、麦粒加蚕蛹粉(WW)、大米(R)、大米加蚕蛹粉(RW)培养基以及接种于活体蚕蛹(CY)上进行培养,采收子实体后对其多糖含量及单糖组成进行比较(表1)。小麦和大米为培养基培养的蛹虫草多糖含量分别为2.75%和3.12%,在小麦和大米中添加蚕蛹粉后培养的蛹虫草多糖含量有增加趋势,分别为3.89%和3.63%,说明常规配料栽培的培养基中添加蚕蛹粉,有增高蛹虫草多糖含量的作用。活体蚕蛹(CY)培养得到的蛹虫草子实体多糖含量达6.19%,显著高于其他组。所有配料栽培处理所得子实体中多糖的单糖组成相同,均由阿拉伯糖、半乳糖、葡萄糖、甘露糖组成,以葡萄糖为主要单糖,占54.99%-68.13%;其他单糖所占比例也稍有差异;蚕蛹上培养的蛹虫草子实体多糖的单糖组成除阿拉伯糖、半乳糖、葡萄糖、甘露糖外,还含有6.35%的鼠李糖,其中葡萄糖也为主要单糖,占64.88%,表明蛹虫草多糖的单糖组成和摩尔比受培养基以及栽培方式的影响。
表1 不同处理对蛹虫草子实体中多糖含量及其单糖组成的影响
Table 1
| 处理 Media | 多糖含量 Polysaccharide content (%) | 单糖组成及摩尔比Monosaccharide composition and percentages (%) | ||||
|---|---|---|---|---|---|---|
| 鼠李糖Rha | 阿拉伯糖Ara | 半乳糖Gal | 葡萄糖Glu | 甘露糖Man | ||
| W | 2.75 0.13 c | - | 2.75 | 12.20 | 67.87 | 17.18 |
| WW | 3.89±0.58 b | - | 11.62 | 9.17 | 62.85 | 16.37 |
| R | 3.12±0.20 bc | - | 5.84 | 14.84 | 54.99 | 24.33 |
| RW | 3.63±0.19 bc | - | 1.28 | 12.27 | 68.13 | 18.32 |
| CY | 6.19±0.19 a | 6.35 | 5.64 | 9.03 | 64.88 | 14.10 |
注:W:100%麦粒;WW:90%麦粒加10%蚕蛹粉;R:100%大米;RW:90%大米加10%蚕蛹粉;CY:蚕蛹. “-”表示未检测到;不同小写字母表示P<0.05水平差异显著. 下同
Note: W: 100% wheat; WW: 90% wheat and 10% silkworm chrysalis powder; R: 100% rice; RW: 90% rice and 10% silkworm chrysalis powder; CY: Silkworm chrysalis. “-” indicates not detected; a significant difference at P<0.05 is indicated by different lower cases. The same below.
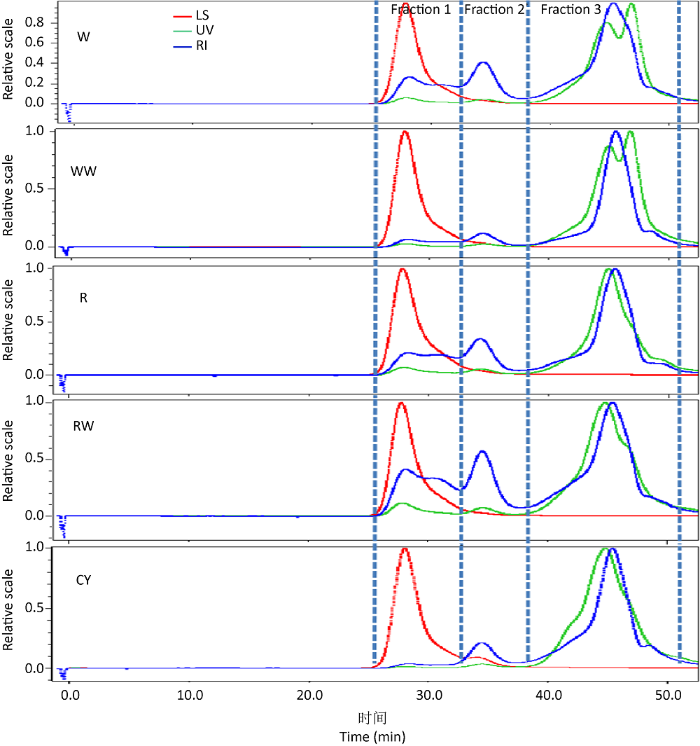
2.1.2 分子量分布特征:由HPSEC-MALLS-RI分析结果可知,不同处理组蛹虫草子实体粗多糖的分子量分布范围相似,均可分为Fraction 1(Mw>107g/mol)、Fraction 2(Mw为106-107g/mol)和Fraction 3(Mw<106g/mol)3个组分,其中Fraction 1和Fraction 2紫外吸收峰弱,说明这2个组分以多糖为主;Fraction 1是Mw为3.450×107-4.092×107的多糖组分,多分散系数为1.410-1.734;Fraction 2是Mw为1.228×106-2.143×106的多糖组分,多分散系数为1.266-1.411;Fraction 3组分除具有明显的示差检测峰外,还具明显的紫外吸收峰,说明这个组分除多糖外还混有蛋白类物质,初步分析该组分是Mw为4.324×104- 1.570×105之间的混合物。不同处理组蛹虫草子实体粗多糖中的3个组分峰面积有差异,特别是Fraction 1组分,在大米加蚕蛹粉栽培的子实体(RW)中峰面积最大,占比为23.5%,表明其中大分子量多糖(Mw为3.450×107-4.092×107)组分含量高;而在活体蚕蛹上培养得到的子实体(CY)中测得Fraction 1的峰面积占比仅为2.9%,表明其中大分子量多糖组分含量较低,该子实体中主要含有中低分子量的多糖组分(Mw<107)(图1和表2)。
图1
图1
不同处理蛹虫草子实体多糖HPSEC-MALLS-RI分析图谱
LS:90°激光光散射检测峰;UV:280nm紫外吸收峰;RI:示差检测峰;Fraction 1:Mw>107g/mol;Fraction 2:Mw 106-107g/mol;Fraction 3:Mw<106g/mol
Fig. 1
HPSEC-MALLS-RI spectrum of polysaccharide in Cordyceps militaris fruiting bodies on different media.
LS: Signals detected by laser light scattering at 90°; UV: Ultraviolet absorption peak; RI: Refractive index; Fraction 1: Mw>107g/mol; Fraction 2: Mw 106-107g/mol; Fraction 3: Mw<106g/mol.
表2 不同处理对蛹虫草子实体多糖分子量分布的影响
Table 2
| 处理 Media | Fraction 1 | Fraction 2 | Fraction 3 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Mw (g/mol) | Mw/Mn | 占比 Proportion (%) | Mw (g/mol) | Mw/Mn | 占比 Proportion (%) | Mw (g/mol) | Mw/Mn | 占比 Proportion (%) | |
| W | 4.092×107 | 1.619 | 16.4 | 1.981×106 | 1.317 | 17.7 | 1.351×105 | 2.147 | 65.9 |
| WW | 3.859×107 | 1.734 | 7.5 | 1.704×106 | 1.266 | 33.5 | 5.525×104 | 2.529 | 84.1 |
| R | 3.450×107 | 1.677 | 17.7 | 2.181×106 | 1.267 | 16.6 | 1.570×105 | 2.245 | 65.8 |
| RW | 3.911×107 | 1.708 | 23.5 | 2.143×106 | 1.362 | 20.2 | 2.129×105 | 2.088 | 57.0 |
| CY | 3.849×107 | 1.410 | 2.9 | 1.228×106 | 1.411 | 12.1 | 4.324×104 | 2.250 | 85.0 |
2.2 核苷类成分的比较
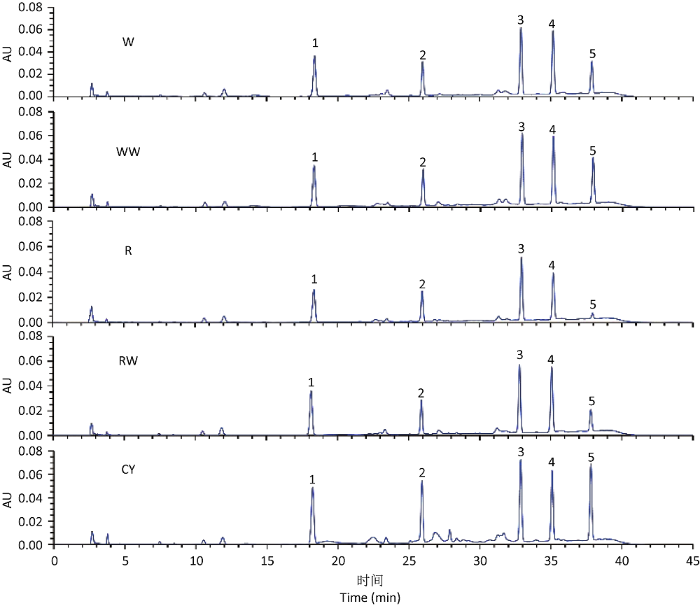
蛹虫草样品的HPLC色谱图表明,各处理子实体中主要核苷类成分为尿苷、鸟苷、腺苷、虫草素和N6-(2-羟乙基)腺苷(图2)。结果显示,大米培养获得的子实体(R)的虫草素含量最低,为1.75µg/mg,其他4个处理的虫草素含量为2.51-2.81µg/mg,之间无显著差异(表3)。在麦粒上培养获得的子实体中核苷含量高于在大米上的处理,并且麦粒添加蚕蛹粉后培养的子实体中尿苷、鸟苷、N6-(2-羟乙基)腺苷含量显著提高,分别提高14.1%、10.2%、45.3%;大米添加蚕蛹粉后培养的子实体中尿苷、虫草素、N6-(2-羟乙基)腺苷含量显著提高,分别提高28.4%、45.7%、285.8%。接种在蚕蛹上的子实体(CY)各主要核苷含量均最高,说明培养基和培养方式显著影响蛹虫草中核苷类成分的含量。
图2
图2
不同处理蛹虫草子实体核苷类成分HPLC色谱图
1:尿苷;2:鸟苷;3:腺苷;4:虫草素;5:N6-(2-羟乙基)腺苷
Fig. 2
HPLC spectrum of nucleosides in Cordyceps militaris fruiting bodies on different media.
1: Uridine; 2: Guanosine; 3: Adenosine; 4: Cordycepin; 5: N6-(2-hydroxyethyl) adenosine.
表3 不同处理对蛹虫草子实体中主要核苷含量的影响
Table 3
| 处理 Media | 尿苷 Uridine | 鸟苷 Guanosine | 腺苷 Adenosine | 虫草素 Cordycepin | N6-(2-羟乙基)腺苷 HEA |
|---|---|---|---|---|---|
| W | 2.98±0.11 b | 1.28±0.03 c | 2.19±0.01b | 2.51±0.03 a | 1.48±0.02 c |
| WW | 3.40±0.09 a | 1.41±0.05 b | 2.28±0.04 b | 2.81±0.12 a | 2.15±0.01 b |
| R | 2.15±0.07 c | 0.95±0.03 d | 1.87±0.02 c | 1.75±0.06 b | 0.24±0.01 e |
| RW | 2.76±0.13 b | 1.05±0.07 d | 1.98±0.03 c | 2.55±0.08 a | 0.95±0.02 d |
| CY | 3.64±0.12 a | 2.34±0.05 a | 2.65±0.02 a | 2.57±0.11 a | 3.52±0.00 a |
2.3 游离糖醇、小分子糖类的比较
不同处理得到的蛹虫草子实体中游离糖醇、小分子糖类含量的测定结果见表4。配料栽培处理培养的蛹虫草中海藻糖含量为20.07%-23.40%,显著高于活体蚕蛹上培养得到的子实体(CY)。配料培养的处理中,麦粒培养的子实体(W)中游离葡萄含量最高,为6.84%,另外3个配料处理的子实体中游离葡萄糖含量为3.50%-3.85%。活体蚕蛹上培养得到的子实体(CY)中游离葡萄糖含量显著高于配料栽培的处理,含量为12.03%,蛹虫草子实体中海藻糖和葡萄糖含量与朱丽娜(2017)在不同菌株中的研究结果一致,海藻糖和葡萄糖含量呈负相关性。大米培养的子实体中甘露醇含量最高为4.42%,显著高于在麦粒上的。在活体蚕蛹上培养得到的子实体(CY)中甘露醇含量为2.90%,麦粒添加蚕蛹粉(WW)的处理为2.94%,大米添加蚕蛹粉(RW)的处理为2.72%,3个处理间无显著差异,而在麦粒或大米中添加蚕蛹粉后,培养所得子实体中甘露醇含量显著下降,与未添加处理相比,分别下降13.5%和38.5%,说明培养基中添加蚕蛹粉可降低甘露醇含量。
表4 不同处理对蛹虫草子实体中游离糖醇、小分子糖类含量的影响
Table 4
| 处理 Media | 海藻糖 Trehalose (%) | 甘露醇 Mannitol (%) | 葡萄糖 Glucose (%) |
|---|---|---|---|
| W | 20.07±0.19 b | 3.40±0.03 b | 6.84±0.36 b |
| WW | 20.34±0.40 b | 2.94±0.07 c | 3.58±0.14 cd |
| R | 20.23±0.61 b | 4.42±0.09 a | 3.85±0.13 c |
| RW | 23.40±0.56 a | 2.72±0.12 c | 3.50±0.07 d |
| CY | 8.41±0.18 c | 2.90±0.00 c | 12.03±0.12 a |
2.4 不同处理蛹虫草子实体品质的评价
比较不同处理所得子实体的活性成分表明,在蚕蛹上培养得到的子实体中多糖和核苷类成分含量高于其他处理。配料中添加蚕蛹粉使蛹虫草中多糖和核苷类成分含量上升,但降低了其中甘露醇的含量。
蛹虫草中活性成分种类较多,对多种成分进行综合评价能更好地反映其内在品质。采用朱丽娜等(2018)建立的蛹虫草子实体品质综合评价方法,对各成分含量的数据进行归一化法处理后,以各成分在品质评价中的重要性为依据给予加权数,然后计算子实体成分的综合分值并排序(表5)。综合分值越高,说明综合品质越好,在蚕蛹上培养的蛹虫草综合评分最高,为0.798,麦粒为主料栽培得到的蛹虫草品质好于大米为主料栽培的,且添加蚕蛹粉的处理优于未添加的处理。
表5 不同处理蛹虫草子实体活性成分含量归一化值及其品质的综合评价
Table 5
| 处理 Media | 多糖 Polysaccharide | 虫草素 Cordycepin | 尿苷 Uridine | 鸟苷 Guanosine | 腺苷 Adenosine | N6-(2-羟乙基)腺苷 HEA | 海藻糖 Trehalose | 甘露醇 Manitol | 综合分值 Total score | 排名 Rank |
|---|---|---|---|---|---|---|---|---|---|---|
| W | 0.000 | 0.717 | 0.557 | 0.237 | 0.410 | 0.378 | 0.778 | 0.400 | 0.395 | 3 |
| WW | 0.358 | 1.000 | 0.839 | 0.331 | 0.526 | 0.582 | 0.796 | 0.129 | 0.595 | 2 |
| R | 0.108 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.789 | 1.000 | 0.169 | 5 |
| RW | 0.256 | 0.755 | 0.409 | 0.072 | 0.141 | 0.216 | 1.000 | 0.000 | 0.388 | 4 |
| CY | 1.000 | 0.774 | 1.000 | 1.000 | 1.000 | 1.000 | 0.000 | 0.106 | 0.798 | 1 |
3 讨论
我国是世界上第一个利用虫蛹人工批量培养蛹虫草子实体的国家(梁曼逸和谷恒生 1987)。随着栽培技术的不断发展,以大米、小麦、玉米等配料为基质栽培蛹虫草的方式得到推广和规模化应用。申鸿等(2012)分别将蛹虫草菌株接种于家蚕蛹、家蚕蛾以及粳米添加蛹粉和糯米添加蛹粉的配料培养基上,结果发现,在家蚕蛹和家蚕蛾上生长的蛹虫草虫草素含量高于粳米添加蛹粉和糯米添加蛹粉上的虫草素含量。蒲彬等(2016)以蚕蛹活体接种和混合培养基(小麦、大米、蚕蛹粉按1:1:0.2比例混合)接种培养蛹虫草,比较这两个处理腺苷、氨基酸、虫草素和多糖含量。结果表明,活体蚕蛹培养的蛹虫草中腺苷含量、氨基酸总量和必需氨基酸含量高于混合培养基培养的蛹虫草,虫草多糖含量比混合培养基培养得到的低,虫草素含量也略低,但该研究未对数据进行差异统计分析。以上研究表明,利用家蚕蛹、蛾培养可以生产出高品质蛹虫草。本研究分别以麦粒、麦粒加蚕蛹粉、大米、大米加蚕蛹粉、活体蚕蛹接种培养蛹虫草,测定多糖含量,多糖分子量分布特征,尿苷、鸟苷、腺苷、虫草素及N6-(2-羟乙基)腺苷、游离糖醇、小分子糖类含量,考察活体蚕蛹接种及目前生产中主要配料培养蛹虫草的品质差异和添加蚕蛹粉对蛹虫草品质的影响。结果表明,在蚕蛹上培养得到的蛹虫草子实体中多糖和核苷类成分都显著高于配料栽培的处理,品质评价的综合评分最高,也表明以昆虫活体寄主为基质进行蛹虫草的仿生培养,可生产出高品质的蛹虫草。但蛹虫草的仿生栽培生产成本和技术要求较高,在实际生产中使用该技术进行规模生产的企业很少。本研究在蚕蛹上培养的子实体多糖含量远高于配料栽培的子实体,蒲彬等(2016)的实验结果中活体蚕蛹培养的子实体多糖含量低于混合培养基的,分别为1 800mg/kg和2 400mg/kg,可能多糖含量受多种因素影响,不同菌株产多糖的最适条件不同。本研究中,以小麦为基质培养的子实体中尿苷、鸟苷、腺苷、虫草素、N6-(2-羟乙基)腺苷含量均高于以大米为基质的处理,说明不同基质来源影响蛹虫草中代谢物质的合成,且在大米和小麦中添加蚕蛹粉后,培养得到的蛹虫草中各核苷含量均有所提高,其中N6-(2-羟乙基)腺苷含量增加最为显著,且子实体品质综合评分也高于未添加的处理,因此使用本研究菌株进行实际生产时,可在配料中添加少量蚕蛹粉,以提高蛹虫草的品质。张红霞等(2016)分别以麦仁和活体蚕蛹为培养基栽培蝉花获得孢梗束,发现蚕蛹感染蝉花菌株获得的蝉花孢梗束中鸟苷、尿苷、腺苷、海藻糖、甘露醇含量高于麦仁培养的处理,但N6-(2-羟乙基)腺苷含量低于麦仁培养的处理。本研究中,蚕蛹上培养得到的蛹虫草,除鸟苷、尿苷、腺苷和N6-(2-羟乙基)腺苷含量均高于各配料栽培的处理,但海藻糖含量显著降低,为8.41%,配料栽培的处理海藻糖含量为20.23%-23.40%,甘露醇含量也显著低于以小麦和大米栽培的处理,红霞等(2016)在蝉花上的研究结这与张果不同,且在配料中添加蚕蛹粉后,蛹虫草的甘露醇含量显著下降,说明培养基对不同物种代谢物质合成的影响有所差异。
由于蛹虫草多糖组成复杂,多糖的单糖组成可以部分反映多糖的结构组成。多角度激光光散射仪不但可测定聚合物和蛋白质等生物高聚物的数均和重均分子量,还可获得聚集态信息(仲宣惟等 2006),因此近年来越来越多地被用于分析多糖的特征(颜梦秋等 2020;张雪梦等 2020),但还未见在蛹虫草多糖中的应用报道。本研究采用凝胶尺寸排阻色谱-多角度激光光散射-示差折光检测仪(HPSEC-MALLS-RI)联用分析蛹虫草多糖,并结合多糖含量和单糖组成,可以更加客观地表征蛹虫草多糖的特性。多糖的活性与其分子量、结构密切相关。本研究不同处理得到的蛹虫草子实体多糖均可分为Fraction 1(Mw>107g/mol)、Fraction 2(Mw 106- 107g/mol)和Fraction 3(Mw<106g/mol)3个组分,但这3个组分的峰面积有所差异,需对3个多糖组分进行分离,明确其活性,从而更好地评价不同处理对蛹虫草活性多糖的影响。
综上所述,虫草的多糖、核苷、糖醇等成分与菌株、培养条件、所用培养基的来源等多种因素相关,在进行规模生产前,筛选所用菌株最适宜的培养基,有助于生产更优质的蛹虫草产品。
参考文献
Cordyceps militaris (L.) Link fruiting body reduces the growth of a non-small cell lung cancer cell line by increasing cellular levels of p53 and p21
DOI:10.3390/molecules200813927
PMID:26263965
[本文引用: 1]

Cordyceps militaris (L.) Link, an edible entomopathogenic fungus widely used in traditional Chinese medicine, has numerous potential medicinal properties including antitumor activity. The methanolic extract of C. militaris fruiting body was recently shown to have tumor cell growth inhibitory activity in several human tumor cell lines. Nonetheless, the mechanism of action involved is still not known. This work aimed at further studying the effect of the methanolic extract of C. militaris regarding its antitumor mechanism of action, using the non-small cell lung cancer cell line (NCI-H460) as a model. Results showed that treatment with the extract decreased cellular proliferation, induced cell cycle arrest at G0/G1 and increased apoptosis. In addition, the extract increased the levels of p53 and p21. Moreover, an increase in p-H2A.X and 53BP1 levels, together with an increase in the number of 53BP1 foci/cell (all indicative of DNA damage), were also observed after treatment with the extract. This work suggests that this extract affected NCI-H460 cellular viability through a mechanism involving DNA damage and p53 activation. This further supports the potential of this extract as a source of bioactive compounds, which may be used in anticancer strategies.
Cordyceps industry in China: current status, challenges and perspectives— Jinhu declaration for cordyceps industry development
Contents of cordycepin and adenosine in Cordyceps militaris cultured on different culture media
Isolation of adenosine, iso-sinensetin and dimethylguanosine with antioxidant and HIV-1 protease inhibiting activities from fruiting bodies of Cordyceps militaris
DOI:10.1016/j.phymed.2010.04.010
PMID:20576416
[本文引用: 1]

According to previous studies, a close relationship between oxidative stress and AIDS suggests that antioxidants might play an important role in the treatment of AIDS. Cordyceps militaris was selected from nine edible mushrooms by assay of inhibition of erythrocyte hemolysis. Macroporous adsorption resin and HPLC were used to purify three micromolecular compounds named L3a, L3b and L3c. L3a was identified to be adenosine with the molecular formula C(10)H(13)N(5)O(4); L3b was 6,7,2',4',5'-pentamethoxyflavone with the molecular formula C(20)H(20)O(7), and L3c was dimethylguanosine with the molecular formula C(12)H(17)N(5)O(5). The compound 6,7,2',4',5'-pentamethoxyflavone was first isolated from C. militaris. The assay of inhibition of HIV-1 protease (HIV-1 PR) was based on the fact that the expression of this enzyme can inhibit the growth of E. coli. This is a new screening system for HIV-1 PR inhibitors. Both L3a and L3b showed high inhibition to HIV-1 PR. These compounds could be new anti-HIV-1 PR drugs.2010 Elsevier GmbH. All rights reserved.
Success in artificial cultivation of Cordyceps
Immunomodulatory and antioxidative activity of Cordyceps militaris polysaccharides in mice
DOI:10.1016/j.ijbiomac.2016.02.009 URL [本文引用: 1]
Comparison and analysis of the main components of Cordyceps militaris cultured in vivo and on powder medium
Growth and quality assessment of Cordyceps militaris cultured on Bombyx mori body and on pupa powder substitute medium
A comparison on morphological characters and active component contents of aweto cultured on silkworm larva inoculated with different Cordyceps militaris strains
Resource diversity of Chinese macrofungi: edible, medicinal and poisonous species
DOI:10.1007/s13225-019-00432-7 URL [本文引用: 1]
Research progress on artificial cultivation and development of Cordyceps militaris
Comparison and optimization of the methods for analyzing the water soluble polysaccharides in Cordyceps militaris
Purification and structure elucidation of high molecular weight polysaccharide from the cell wall of Ganoderma sinense
Comparison of active ingredients in Cordyceps sobolifera coremium cultivated artificially on different media
Receptor activation effect of cell wall polysaccharides of Sparassis latifolia fruiting body
Determination of molecular weight and molecular weight distribution of chitosan by mall in conjunction with refractive index detector
Determination of carbohydrates by high performance anion chromatography-pulsed amperometric detection in mushrooms
DOI:10.1615/IntJMedMushr.v14.i4 URL [本文引用: 1]
Study on polysaccharide from Cordyceps militaris fruit bodies and Cordyceps militaris quality evaluation and application
Comparison of the active components in fruit bodies of different strains of Cordyceps militaris
Effect of culture time on the bioactive components in the fruit bodies of caterpillar mushroom, Cordyceps militaris CM-H0810
DOI:10.1615/IntJMedMushrooms.v21.i11 URL [本文引用: 1]
Free alditol and low molecular levels in Cordyceps militatris
我国虫草产业发展现状、问题及展望:虫草产业发展金湖宣言
广叶绣球菌子实体细胞壁多糖特征及其体外激活 Dectin-1受体活性