漏斗多孔菌Polyporus arcularius (Batsch) Fr.又名漏斗棱孔菌,分类上隶属多孔菌目Polyporales、多孔菌科Polyporaceae、多孔菌属Polyporus。该种在我国广泛分布,夏秋季生于多种倒木及枯树上,主要在阔叶树树木上(戴玉成 2010;Cui et al. 2019)。漏斗多孔菌是多孔菌科一种可食的大型真菌,该菌幼嫩时柔软,可以食用,干时变硬。但野外采集的漏斗多孔菌子实体个体较小,数量较少,尚未真正开发为食用品种。漏斗多孔菌也具有很好的食药用应用前景,该菌对小白鼠肉瘤180抑制率为90%,对艾氏癌抑制率为100%(黄年来 1998;Wu et al. 2019)。
国外对该菌的报道不多,日本学者早在1968年就开始漏斗多孔菌的相关研究,报道了光照对漏斗多孔菌子实体形成的影响,随后又有学者对漏斗多孔菌子实体形成机理及不同光质、高温和外施酶抑制剂等对子实体形成的影响进行了系统研究(Kitamato 1968, 1974, 1999;Azuma 2014),但生产栽培尚未形成产业化,国内关于该菌的报道集中在资源调查方面,相关研究报道仅有漏斗大孔菌液体发酵产漆酶条件研究(王剑锋等 2009)、发酵液化学成分检测(尹伟等 2012)、菌种鉴定及其生物学特性(钟丽娟 2013)、漏斗大孔菌免疫调节蛋白的制备与应用(鲍大鹏等 2009)等。研究表明漏斗多孔菌菌丝生长的适宜范围为25-40℃(钟丽娟 2013),生长温度范围较宽,且该菌极易形成子实体,为耐高温种类,具有补充食用菌工厂化生产的应用潜力。
为进一步加快漏斗多孔菌开发应用,本文以单因素试验为主,优化了液体菌种培养基配方及培养工艺参数,获得质量良好的液体菌种,并进行了栽培效果研究。旨在为后续生产实践提供理论依据。
1 材料与方法
1.1 供试菌株和培养基
1.1.1 供试菌株:子实体采自辽宁省鞍山市岫岩满族自治县野外林地中,经形态学鉴定及ITS序列分析(GenBank No. 560857)确定为漏斗多孔菌。标本现保藏于辽宁省微生物菌种保藏中心大型真菌标本馆,编号LNBY-00397。菌株分离于采集的新鲜子实体,现保藏于辽宁省微生物菌种保藏中心农业微生物种质资源库,编号LCCC60025。
1.1.2 培养基:综合PDA培养基:马铃薯(去皮)200.0g,葡萄糖20.0g,MgSO4·7H2O 1.5g,KH2PO4 3.0g,琼脂18.0g,蒸馏水1 000mL,pH自然。种子液培养基:马铃薯(去皮)200.0g,葡萄糖20.0g,MgSO4·7H2O 1.5g,KH2PO4 3.0g,K2HPO4 1.0g,蒸馏水1 000mL,pH自然,装液量150mL/500mL。上述培养基121℃,灭菌30min。
1.2 种子液制备
将4℃冰箱保藏的菌株转接至综合PDA平板上,32℃恒温培养4d,用直径为6mm的打孔器沿菌落边缘打孔,每瓶接种5块。接种后置于32℃、150r/min摇床振荡培养4d,备用。
1.3 培养基碳源、氮源筛选
在原有菌丝生长试验基础上,设计单因素试验,根据不同碳源、不同氮源配制液体培养基,装液量150mL/500mL,接种2%种子液后,置于32℃、150r/min摇床振荡培养6d,感官评价液体菌种质量并进行菌球直径、菌球密度、菌丝干重等指标测定。每处理设置3次重复。
碳源试验基础配方为:碳源20.0g,马铃薯(去皮)200.0g,MgSO4·7H2O 1.5g,KH2PO4 3.0g,K2HPO4 1.0g,蒸馏水1 000mL,pH 5.0。碳源设置葡萄糖、玉米粉、蔗糖、红糖、细木屑5个不同处理。氮源试验基础配方为:氮源5.0g,马铃薯(去皮)200.0g,MgSO4·7H2O 1.5g,KH2PO4 3.0g,K2HPO4 1.0g,蒸馏水1 000mL,pH 5.0。氮源设置蛋白胨、酵母膏、牛肉膏3个处理。
1.4 培养条件优化
确定液体菌种培养基后,参考菌丝生长试验结果,进行培养条件优化实验。供试培养基为:马铃薯(去皮)200g、玉米粉20g、蛋白胨5g、KH2PO4 3.0g、K2HPO4 1.0g,MgSO4·7H2O 1.5g,初始pH 5.0。基础培养条件为:接种量2%,培养温度32℃,装液量150mL/500mL,转速150r/min,培养周期6d。温度试验设置30、32、34、36℃共4个处理,每处理设置3次重复。装液量设置为150mL/500mL、250mL/500mL、350mL/500mL共3个处理,每处理设置3次重复。摇床转速设置150、170、190r/min共3个处理,每处理设置3次重复。初始pH设置为pH 4.0、pH 5.0、pH 6.0共3个处理,培养基配方同前,pH调节采用柠檬酸和柠檬酸钠溶液进行调节(段应策等 2020;董浩然等 2021),于灭菌前用25mmol/L柠檬酸(pH 2.6)和50mmol/L柠檬酸三钠(pH 8.2)分别将液体培养基的初始pH值调节至pH 4.0、pH 5.0、pH 6.0,并于灭菌后用25mmol/L柠檬酸和50mmol/L柠檬酸三钠微调pH值至设置值。每处理制备4瓶培养基,其中1瓶用于测定灭菌后pH值及确定柠檬酸或柠檬酸钠微调用量时使用。
1.5 摇瓶液体菌种工艺确定
在确定各培养条件最优参数的基础上,以确定的液体菌种配方为培养基,进行液体菌种培养验证试验,并以最初培养条件即装液量150mL/500mL、32℃、150r/min为对照。分别在培养4、5、6、7d感观评价液体菌种质量并进行指标测定,每处理设置3次重复。
1.6 液体菌种与固体菌种对漏斗多孔菌栽培效果的影响
1.6.1 液体菌种制备:以试验确定的最佳配方及最佳培养条件制备漏斗多孔菌液体菌种。
1.6.2 固体菌种制备:固体菌种配方(质量百分比)为细木屑65%、玉米粉10%、麸皮10%、葡萄糖5%、KH2PO4 2%、K2HPO4 1.5%、MgSO4·7H2O 1.5%、谷氨酸钠2%、蛋白胨1%、石灰1%、石膏1%;料水比1:1.5。按配方制作培养料,分装至菌种瓶中,每瓶2/3装量,盖上配套透气盖,置于121℃,灭菌2h,自然降温,待菌种瓶温度低于35℃后,可以接种。于无菌条件下,将斜面母种接种至菌种瓶中央,封口,35℃恒温培养,培养12-15d满瓶后备用。
1.6.3 栽培料配方:配方A(质量百分比):细木屑86.5%,麸皮8.5%,豆粕3%,石膏1%,石灰1%,料水比1:1.7。配方B(质量百分比):细木屑46%、黑木耳废菌棒(出耳3潮)40%、麸皮12%、石灰1%、石膏1%,料水比1:1.7。配方C(质量百分比):细木屑66%、玉米秸秆粉20%、麸皮12%、石灰1%、石膏1%,料水比1:1.7。
栽培袋为规格17cm×35cm聚丙烯袋,其中配方A设置接种液体菌种和传统固体菌种2个处理,以传统固体菌种作为对照,配方B和配方C均接种液体菌种。每个配方设置30袋,每袋栽培料干重500g,湿重1 350g。养菌培养条件为32℃恒温培养箱,出菇环境为小型人工气候室,温度为28-32℃,空气相对湿度为80%-90%。
1.7 指标测定
1.7.1 菌种感观指标测定:菌丝生物量测定:采用差量法进行测定;每一瓶单独操作。将培养好的液体菌种,用擦镜纸过滤后,清水冲洗3次,放置至无水滴滴下,将菌丝置于恒温烘干箱中60℃至恒重后测定干重,3次重复求平均值。菌球密度测定:取10mL液体菌种,倒入培养皿中,计数全部菌球除以体积10mL即为菌球密度,菌球总数即为菌球密度与液体菌种体积之积,每处理3次重复。菌球直径测定:测定菌球密度后,随机挑取10个菌球,将其紧密相连排成一条直线,用直尺测量其总长度,总长度除以数量10,即为单个菌球平均直径(张怡等 2016),每处理2次重复。
1.7.2 栽培农艺性状测定:记录各处理养菌周期、原基产生时间,每个配方随机挑取15棒出菇状态一致的菌棒,每5棒为一个重复,对每棒采摘的子实体数量进行计数,取平均值;记录各处理子实体总重量。
2 结果与分析
2.1 不同原料对漏斗多孔菌液体菌种生长的影响
2.1.1 不同碳源对漏斗多孔菌液体菌种生长的影响:不同碳源对液体菌种的菌球直径有影响,以葡萄糖、玉米粉和细木屑作为碳源时,菌球直径略大,约4.0mm左右,与蔗糖和红糖配方相比差异性显著;不同碳源对菌球密度的影响较大,以葡萄糖作为碳源时菌球密度最高(含面包屑状小菌丝团),可达18.6个/mL,其次为细木屑和玉米粉配方,菌球密度均高于17.0个/mL(表1),以上3个处理明显优于蔗糖和红糖配方;菌丝干重测定结果表明,以玉米粉和细木屑作为碳源时,菌丝生物量最高,100mL液体菌种菌丝干重可达1.5g以上,显著高于其他碳源,其次是葡萄糖和蔗糖,而红糖不适宜作为碳源。结果表明,漏斗多孔菌菌丝适应性较强,多种碳源均可用于其液体菌种生产,结合菌球直径、菌球密度及菌丝干重测定结果,考虑原料来源与质量控制、发酵罐生产时配料及清洗环节,选择玉米粉作为碳源更适宜。
表1 碳源对漏斗多孔菌液体菌种生长的影响
Table 1
| 碳源 Carbon source (20g/L) | 液体菌种性状 Characters of liquid culture | 菌球直径 Diameter of mycelial spheroid (mm) | 菌球密度 Density of mycelial spheroid (individual number/mL) | 菌丝干重 Mycelial dry weight (g/100mL) |
|---|---|---|---|---|
| 葡萄糖 Glucose | 澄清,密集,菌球整齐 Clarified, dense, uniform | 3.98±0.10 a | 18.6±0.10 a | 1.3560±0.0267 b |
| 玉米粉 Corn flour | 浑浊,黏稠,密集,菌球整齐 Cloudy, thick, dense, uniform | 4.03±0.06 a | 17.3±0.98 b | 1.5342±0.0134 a |
| 蔗糖 Sucrose | 中等黏稠,菌球较整齐 Medium thick, uniform | 3.75±0.07 b | 13.7±0.36 c | 1.0145±0.0385 c |
| 红糖 Brown sugar | 澄清,稀疏,菌球不整齐 Clarified, sparse, inhomogeneous | 3.28±0.08 c | 3.9±0.20 d | 0.4253±0.0586 d |
| 细木屑 Fine wood sawdust | 澄清,密集,菌球整齐 Clarified, dense, uniform | 4.01±0.08 a | 17.5±0.26 b | 1.5326±0.0289 a |
注:数字为均值±标准差;不同小写英文字母表示处理间5%水平差异显著. 下同
Note: Values are the means±SD, and different lower case letters indicate significant difference at 5% level. The same below.
2.1.2 不同氮源对漏斗多孔菌液体菌种生长的影响:不同供试氮源对菌球直径影响较大,3个处理组间差异性显著,其中以蛋白胨作为氮源时,菌球直径最大,其次为牛肉膏、酵母膏;不同氮源也影响液体菌种的菌球密度,以蛋白胨为氮源时菌球密度明显优于牛肉膏和酵母膏配方,其菌丝生物量也最高,100mL液体菌种菌丝干重可达1.3g以上,显著高于其他氮源(表2)。由试验结果可知以蛋白胨为氮源所获得的液体菌种菌球密度最大,菌丝收率最高,且从培养基配制、生产成本等方面考虑,选择蛋白胨作为最佳氮源。
表2 氮源对漏斗多孔菌液体菌种生长的影响
Table 2
| 氮源 Nitrogen source (5g/L) | 液体菌种性状 Characters of liquid culture | 菌球直径 Diameter of mycelial spheroid (mm) | 菌球密度 Density of mycelial spheroid (individual number/mL) | 菌丝干重 Mycelial dry weight (g/100mL) |
|---|---|---|---|---|
| 牛肉膏 Beef paste | 澄清,菌球整齐 Clarified, uniform | 3.85±0.06 b | 17.0±1.0 b | 1.1841±0.0331 b |
| 酵母膏 Yeast extract | 澄清,菌球整齐,色深 Clarified, uniform, dark-colored | 3.69±0.04 c | 15.9±0.4 b | 0.9523±0.0180 c |
| 蛋白胨 Peptone | 澄清,菌球整齐 Clarified, uniform | 4.01±0.03 a | 19.2±0.4 a | 1.3412±0.0971 a |
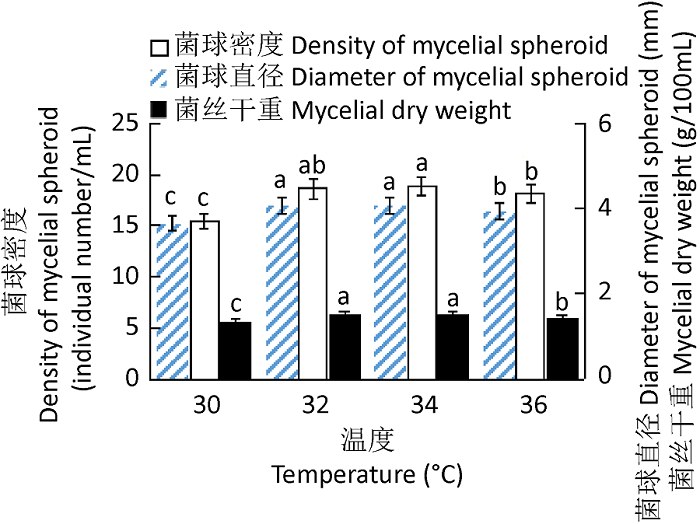
2.2 不同培养条件对漏斗多孔菌液体菌种生长的影响
图1
图1
温度对漏斗多孔菌液体菌种生长的影响
Fig. 1
Effects of temperature on the growth of liquid culture of Polyporus arcularius.
图2
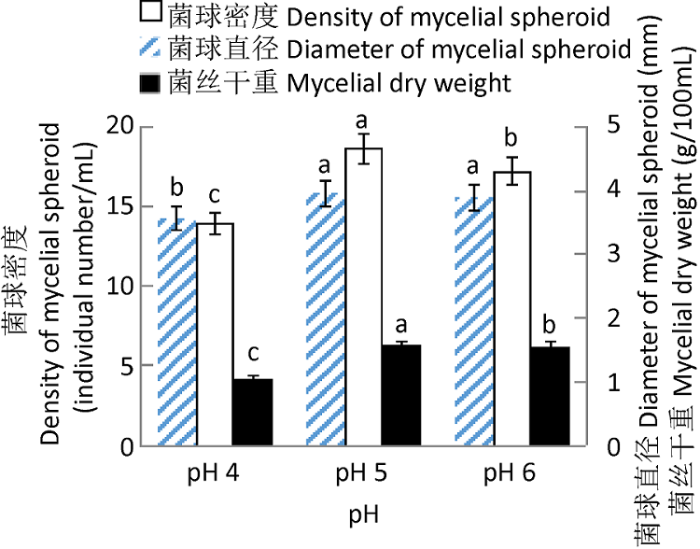
图2
pH对漏斗多孔菌液体菌种生长的影响
Fig. 2
Effects of pH on the growth of liquid culture of Polyporus arcularius.
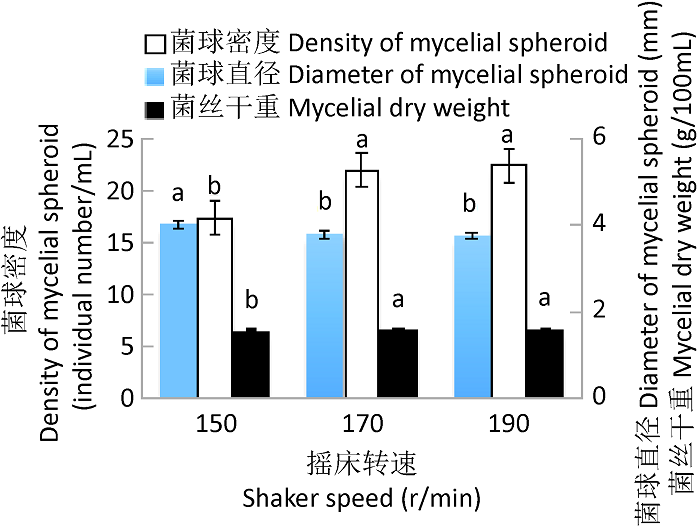
2.2.3 不同摇床转速对漏斗多孔菌液体菌种生长的影响:摇床转速对溶解氧影响较大,进而对液体菌种质量产生影响,结果表明,摇床转速对菌球密度有明显影响,转速提高利于菌球密度增加,170r/min和190r/min两处理间差异不显著,与150r/min处理相比差异性显著;此外转速也影响菌球直径,170r/min和190r/min所获得的液体菌种菌球直径组间差异性较小,明显小于150r/min处理,综合感观指标选择适宜摇床转速为170r/min(图3)。
图3
图3
摇床转速对漏斗多孔菌液体菌种生长的影响
Fig. 3
Effects of shaker speed on the growth of liquid culture of Polyporus arcularius.
2.2.4 不同装液量对漏斗多孔菌液体菌种生长的影响:装液量与溶解氧供给密切相关,是液体菌种生产主要技术参数之一,结果表明,随着装液量增加,单位体积菌球密度和菌丝干重呈下降趋势(表3)。3个处理组间差异性显著,试验结果表明装液量对液体菌种质量的影响较大;装液量为150mL/500mL时液体菌种的单位面积菌球密度和菌丝干重最优,但实际生产中应考虑生产成本,从菌球总数量、菌球直径、菌球密度、菌丝干重等多方面比较,选择装液量为250mL/500mL,既可减少工作量,又能获得质量较好的液体菌种。
表3 装液量对漏斗多孔菌液体菌种生长的影响
Table 3
| 装液量 Liquid capacity | 液体菌种性状 Characters of liquid culture | 菌球直径 Diameter of mycelial spheroid (mm) | 菌球密度 Density of mycelial spheroid (individual number/mL) | 菌丝干重 Mycelial dry weight (g/100mL) | 菌球总数 Total number |
|---|---|---|---|---|---|
| 150mL/500mL | 黏稠,密集,菌球整齐 Thick, dense, uniform | 3.98±0.06 a | 18.7±0.7 a | 1.5213±0.0165 a | 2 805±108 c |
| 250mL/500mL | 黏稠,密集,菌球整齐 Thick, dense, uniform | 3.75±0.04 b | 17.5±0.3 b | 1.4572±0.0294 b | 4 375±66 b |
| 350mL/500mL | 中等黏稠,密集,菌球整齐 Moderately thick, dense, uniform | 3.52±0.17 c | 14.0±0.3 c | 1.3611±0.0403 c | 4 900±92a |
2.3 摇瓶液体菌种工艺确定
在液体培养基和培养工艺单因素试验基础上,综合各工艺参数,以液体菌种配方为马铃薯(去皮)200g、玉米粉20g、蛋白胨5g、KH2PO4 3.0g、K2HPO4 1.0g,MgSO4·7H2O 1.5g,初始pH 5.0,优化后的培养条件为装液量250mL/500mL、接种量2%、转速170r/min、培养温度32℃,与初始培养条件装液量为150mL/500mL、转速为150r/min进行比较(表4),随培养时间延长,菌球数量呈增加趋势,在培养4-7d内增加幅度呈下降趋势,与液体菌种生长周期规律相符;优化工艺培养第6天和第7天菌球密度差异性不显著,虽然菌球总数差异性显著,但培养至第7天时液体菌种黏稠度下降,上层出现澄清液,表明液体菌种即将老化,因此应选择培养5-6d的液体菌种作为种子。比较不同培养工艺培养6d时的总菌球数量,结果表明优化后菌球总数提高了73%,且液体菌种质量良好,确定培养周期为6d。
表4 优化后的培养工艺对漏斗多孔菌液体菌种生长的影响
Table 4
| 试验处理 Treatment | 菌球密度 Density of mycelial spheroid (individual number/mL) | 菌球总数 Total number of mycelial spheroid | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 4d | 5d | 6d | 7d | 4d | 5d | 6d | 7d | ||
| 优化Optimized | 11.9±0.2 g | 15.8±0.3 d | 19.0±0.3 b | 19.5±0.3 b | 2 975±50 e | 3 950±66 c | 4 750±66 b | 4 875±75 a | |
| 对照CK | 12.5±0.1 f | 15.2±0.5 e | 18.3±0.2 c | 20.6±0.5 a | 1 875±15 g | 2 280±69 f | 2 745±30 f | 3 090±75 d | |
2.4 栽培试验
栽培试验表明,液体菌种栽培的菌袋满袋时间提前7d,原基产生提前8d,子实体数量、头潮菇鲜重与固体菌种相比差异性显著,子实体数量增加13.5%,头潮菇产量提高22.5%;不同代料配方栽培试验结果表明,添加黑木耳菌糠和玉米秸秆粉之后增加了培养料之间的透气性,菌丝生长更快速,菌袋满袋时间提前1d,但原基产生时间晚1-4d,配方B和配方C子实体数量分别减少29.3%、14.7%,头潮菇鲜重减少34.6%、11.3%(表5)。试验结果表明,最优栽培配方为配方A,其次为配方C,配方B可以正常出菇,但子实体产量受明显影响。
表5 漏斗多孔菌出菇试验结果
Table 5
| 试验处理 Treatment | 满袋时间 Mycelial sackful colonization period (d) | 原基产生 Primordium formation period (d) | 子实体数量 Number of fruiting bodies | 头潮菇鲜重 The first harvest fruiting body fresh weight (g) |
|---|---|---|---|---|
| 配方A-固体菌种 Formula A-solid culture | 22 | 41 | 96±2.0 b | 220.8±22.87 b |
| 配方A-液体菌种 Formula A-liquid culture | 15 | 33 | 109±6.4 a | 270.6±11.56 a |
| 配方B-液体菌种 Formula B-liquid culture | 14 | 37 | 77±1.9 c | 177.1±5.53 c |
| 配方C-液体菌种 Formula C-liquid culture | 14 | 34 | 93±3.8 ab | 240.0±27.04 ab |
Note: Formula A: 86.5% sawdust, 8.5% bran, 3% soybean meal, 1% gypsum, 1% lime, material to water ratio 1:1.7; Formula B: 40% mushroom residue of Auricularia auricula (harvested 3 times), 12% bran, 1% lime, 1% gypsum, material to water ratio 1:1.7; Formula C: 66% sawdust, 20% corn stalk meal, 12% bran, 1% lime, 1% gypsum, material to water ratio 1:1.7.
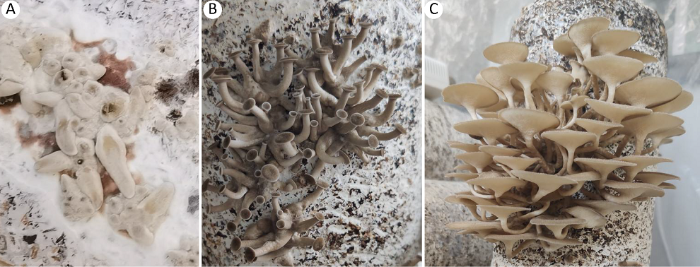
子实体形成过程见图4,接种液体菌种33d后开始产生原基,在温度28-32℃,湿度80%-90%出菇环境下,子实体生长较快,培养2d后可见原基伸长先分化形成菌柄,长度至近1cm(图4A);培养4d后菌柄伸长至1.5-3cm,分化形成菌盖(图4B),培养7-8d后子实体发育成熟(图4C)。人工栽培时漏斗多孔菌以丛生形态为主,少数单生,与野生环境中单生、散生的生长状态完全不同。栽培获得的子实体菌盖延生、扁平且中部脐状,生长后期边缘平展或翘起,形似漏斗状,菌盖被鳞片,菌柄细长等基本形态与野外采集标本相似,但子实体大小、菌盖及菌柄颜色变化有所差别,子实体较野生子实体个体大,野外采集的子实体菌盖直径为2.5-4.5cm,栽培子实体菌盖直径为3.5-7.5cm,子实体颜色明显变浅,为淡灰褐色,鳞片颜色及密度较野生子实体减少,鳞片明显;菌肉白色或污白色,厚度2-3mm,略有增厚。菌管白色,干燥时呈淡黄色,典型延生,菌管形态未发生明显变化。菌柄与野外采集标本相比略长,长度4-8cm,粗2-6mm,菌柄颜色较野生子实体色浅,中生及偏中生,圆柱形,基部绒毛不明显,菌柄长度与通风管理和湿度管理关系密切,湿度大、通风不良易造成菌柄过度生长。
图4
图4
漏斗多孔菌子实体形成过程
A:子实体原基形成;B:菌柄伸长生长及菌盖分化;C:子实体发育成熟
Fig. 4
Formation process of fruiting body of Polyporus arcularius.
A: Fruiting body primordium formation; B: Stipe elongation growth and pileus differentiation and development; C: The mature fruiting bodies.
3 结论与讨论
野生食药用菌驯化栽培为食用菌产业提供新发展机遇。珍稀食药用菌如羊肚菌Morchella importuna(刘伟等 2016)、烟色离褶伞Lyophyllum fumosum(刘娜等 2020)、绣球菌Sparassis latifolia(马璐等 2020)等种类逐步规模化,褐褶边小奥德蘑Oudemansiella brunneo-marginata(祁亮亮等 2011)、毛榆孔菌Elmerina hispida(郭迪哲等 2019)、珊瑚猴头菇Hericium coralloides(张伟彤等 2021)等菌种选育与驯化栽培陆续开展,据统计截至目前食用菌形成商品规模生产的品种已超过50种,规模化栽培有30多种,食用菌产业形成了大宗品种稳步发展、珍稀品种较快发展、药用菌异军突起的发展状态(李玉 2018)。
本研究表明,液体菌种可以明显缩短漏斗多孔菌发菌时间,且对头潮菇产量有明显促进作用;不同配方试验结果表明,黑木耳菌糠和玉米秸秆均可被漏斗多孔菌分解利用并正常出菇,虽然出菇产量与未替代配方相比略有下降,可能与黑木耳菌糠和玉米秸秆营养组成及替代比例不同有关,但试验结果为菌糠基质化利用、秸秆代料栽培等方面的研究提供了理论依据,后续将通过优化栽培配方改善出菇产量。
参考文献
Basidifferquinone, a new inducer for fruiting-body formation of a basidiomycetes Favolus arcularius from a streptomyces strain II
Species diversity, taxonomy and phylogeny of Polyporaceae (Basidiomycota) in China
DOI:10.1007/s13225-019-00427-4 URL [本文引用: 1]
Species diversity of wood-decaying fungi in Northeast China
Effects of nutrient solution pH on Lentinus edodes mycelium
Effects of pH and buffering on the growth of Lentinula edodes mycelium
Solid incubation, domestic cultivation and cellulase activities of Elmerina hispida
Colored illustrstions of macrofungi (Mushroons) of China
Effects of high-temperature treatment on two essential light processes and an intervening dark process in photoinduced pileus primordium formation of a basidiomycete, Favolus arcularius
DOI:10.1007/BF02464288 URL [本文引用: 1]
Growth of fruit-bodies in Favolus arcularius
Light-induced formation of fruit-bodies in a basidiomycete, Favolus arcularius (Fr.) Ames
The status, opportunities and challenges of edible fungi industry in China: develop with Chinese characteristics, realize the dream of powerful mushroom industrial country
Study on optimization of cultivation conditions of liquid strains and industrial production of Lyophyllum fumosum
Morphological and structural analysis of mitospore of Morchella importuna
Liquid fermentation of Sparassis latifolia on different carbon and nitrogen source combinations
Selected biological characteristics and artificial cultivation of Oudemansiella brunneomarginata
Production of laccase from Polyporus arcularius A 08 by submerged fermentation
Resource diversity of Chinese macrofungi: edible, medicinal and poisonous species
DOI:10.1007/s13225-019-00432-7 URL [本文引用: 1]
Chemical constituents of Favolus arcularius
Study on liquid culture of Hericium Coralloides and its cultivation effects
Optimization of shaking flask fermentation medium of Flammulina velutipes
The Study on the biological characteristics of mycelia of wild Favolus arcularius