灵芝Ganodema lingzhi S.H. Wu, Y. Cao & Y.C. Dai是担子菌门、伞菌纲、多孔菌目、多孔菌科、灵芝属真菌(Cao et al. 2012;戴玉成等 2013;Richter et al. 2015;Gu et al. 2018),在我国具有2 000多年的应用历史,被用于治疗肝炎、肾炎、支气管炎、高血压、糖尿病和癌症等多种疾病(Sri et al. 2010;Wu et al. 2019)。灵芝化学成分复杂,主要有多糖、三萜、核苷酸、蛋白质等(于华峥等 2016;温宝庆等 2019),其中三萜类化合物是灵芝活性成分之一,具有抗癌抗肿瘤、抗病毒、养肝护肝、降血压、降胆固醇和抗神经性疾病等作用(黄艳娟和肖桂林 2008;Salah et al. 2008;Cor et al. 2018;Liang et al. 2019),已成为灵芝相关药材和产品的定量检测指标。
灵芝三萜的定量方法中色谱法较分光光度法更为准确,美国药典已采用UPLC定量了其中10种灵芝三萜的含量(Da et al. 2015),并以灵芝酸A为对照品建立一测多评法,由于UPLC仪器设备昂贵,目前不具普适性,建立HPLC法测定灵芝中三萜类成分具有更好的应用价值。HPLC法测定灵芝三萜的方法已经有不少相关报道,如运用HPLC建立11种三萜类成分的测定方法(蒋婷婷等 2015),用HPLC建立了9种三萜类成分的测定方法(李保明等 2012)。但目前HPLC法测定灵芝三萜还存在较多影响准确定量的问题,如分离度问题,灵芝酸A和灵芝酸H在一些HPLC分析条件下色谱峰重合为一个峰,如17种三萜类成分的测定方法(Liu et al. 2017),6种三萜类成分的测定方法(Wang et al. 2006)以及李保明等(2012)建立的9种三萜类成分的测定方法均存在灵芝酸A和灵芝酸H没有分离度的问题,而灵芝酸A作为一测多评法中的内参物,有必要与其他三萜达到基线分离,才能准确计算一测多评方法中其他三萜类成分的相对校正因子;灵芝三萜纯度问题,由于不同来源的灵芝三萜纯度相差较大,导致测定的结果有较大的差异(赵佳等 2009;贾红岩等 2017;杨志空等 2020)。
以灵芝子实体为原料的药品生产主要为水提工艺,前期研究发现热水提取后中等极性三萜溶出率达到85%以上,灵芝酮三醇等低极性三萜提取率极低(冯娜等 2017),而目前灵芝子实体三萜类成分的HPLC测定方法涵盖了中等极性和低极性三萜,直接用于灵芝子实体水提物及相关产品的检测会造成溶剂浪费并增加时间成本,因此需要针对灵芝水提物中的三萜种类建立相应的测定方法。本研究在前期基础上建立了能同时测定灵芝酸C2、灵芝酸G等10种三萜类成分的HPLC方法,并测定了灵芝子实体原料、灵芝水提物和市售灵芝产品中10种三萜的含量,为灵芝水提物及其相关产品中三萜质量标准的建立奠定了基础。
1 材料与方法
1.1 供试材料
1.1.1 样品
灵芝子实体样品均由上海市农业科学院国家食用菌工程技术研究中心提供,灵芝水提物样品为实验室水提制备,灵芝水提物产品均为实体购买。
1.1.2 试剂
无水乙醇、乙酸(分析纯,国药集团化学试剂有限公司);乙腈(色谱纯,美国Dikma公司);水为超纯水。
1.1.3 仪器设备
Waters e2695高效液相色谱仪,Waters 2998 PDA检测器(美国Waters公司);Agilent Zorbax SB-Aq C18色谱柱(250 mm× 4.6 mm,5 μm) (安捷伦科技有限公司);MS3002TS电子天平[梅特勒-托利多仪器(上海)有限公司]。
1.2 方法
1.2.1 色谱条件优化
通过考察分离效果,筛选出最适合的色谱柱;选择流动相为乙腈-乙酸水(0.01%)进一步优化洗脱条件并确定最佳洗脱程序;色谱条件为:进样量10 μL,柱温30 ℃,流速1.0 mL/min,检测波长252 nm。
1.2.2 标品溶液配制
精密称取三萜标准品灵芝酸C2、灵芝酸G、灵芝烯酸B、灵芝酸B、灵芝酸A、灵芝酸H、赤芝酸A、灵芝烯酸D、灵芝酸D和灵芝酸F,分别加甲醇配制成2 mg/mL标准溶液,根据相同浓度的不同标准品色谱峰面积大小,按照各标准品色谱峰面积相等的原则,将各标准品按相应比例配制、混匀并稀释成7个系列浓度的混合标准溶液,备用。
1.2.3 样品前处理
以无水乙醇为提取溶剂,其中灵芝子实体和水提物产品料液比1:20,灵芝子实体水提物样品料液比1:100,按照相应的料液比配制样品溶液,超声提取30 min,上清液经0.22 μm有机滤膜过滤,取滤液备用。
2 结果与分析
2.1 色谱条件优化
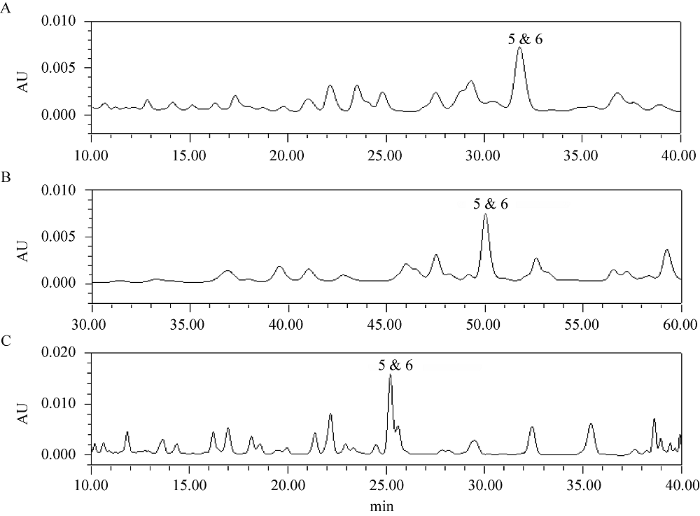
考察4种不同型号的色谱柱Agilent Eclipse Plus C18 (4.6 mm × 250 mm,5 μm)、Agilent ZORBAX SB-AQ C18 (4.6 mm × 250 mm,5 μm)、HUBBLE-C18 (4.6 mm × 250 mm,5 μm)和Waters CORTECS C18 (150 mm × 4.6 mm,2.7 μm)色谱柱,通过对比分析4根色谱柱对同一供试样品的测定结果发现,Agilent ZORBAX SB-C18 (4.6 mm × 250 mm,5 μm)色谱柱对样品中灵芝酸A和灵芝酸H的分离效果最好,最终选择具有最佳分离效果的Agilent ZORBAX SB-C18 (4.6 mm × 250 mm,5 μm)色谱柱,并对其洗脱条件进行优化,得到最佳洗脱程序为:乙腈(A)-(0.01%)乙酸水溶液(B):0 min,29% A;10 min,30% A;55 min,38% A;57→60 min,100% A。在该色谱条件下,能同时将灵芝酸A和灵芝酸H及其他色谱峰较好地分离(图1)。
图1
图1
不同色谱柱的HPLC图谱 A:Agilent Eclipse Plus C18 (4.6 mm×250 mm,5 μm);B:HUBBLE-C18 (4.6 mm×250 mm,5 μm);C:Waters CORTECS C18 (150 mm×4.6 mm,2.7 μm). 5:灵芝酸A;6:灵芝酸H
Fig. 1
Chromatogram of different columns. A: Agilent Eclipse Plus C18 (4.6 mm×250 mm, 5 μm); B: HUBBLE-C18 (4.6 mm×250 mm, 5 μm); C: Waters CORTECS C18 (150 mm×4.6 mm, 2.7 μm). 5: Ganoderenic acid A; 6: Ganoderenic acid H.
2.2 方法学验证
2.2.1 线性关系
表1 不同三萜类成分方法学数据
Table 1
| 标准溶液 Standard samples | 回归方程 Regressive equations | 相关系数 Correlative coefficient | 线性范围 Linear bounds (μg/mL) | 相对校 正因子 Relative correction factors | 精密度 Precision (%) | 重复性 Repeatability (%) | 稳定性 Stability (%) | 平均回 收率 Recovery (%) | 加样回收率相 对标准偏差 Relative standard deviation of sample recovery (%) |
|---|---|---|---|---|---|---|---|---|---|
| 灵芝酸C2 Ganoderic acid C2 | Y=8.97e+ 003X- 1.38e+003 | 0.9996 | 2.188-280 | 1.08 | 0.54 | 2.98 | 2.54 | 99.66 | 1.33 |
| 灵芝酸G Ganoderic acid G | Y=6.08e+ 003X+ 1.84e+003 | 0.9996 | 2.656-340 | 1.59 | 0.20 | 1.36 | 1.49 | 100.24 | 0.45 |
| 灵芝烯酸B Ganoderenic acid B | Y=2.24e+ 004X+ 3.35e+003 | 0.9994 | 0.781-100 | 0.43 | 0.02 | 0.02 | 2.43 | 99.01 | 1.71 |
| 灵芝酸B Ganoderic acid B | Y=8.91e+ 003X- 1.07e+003 | 0.9996 | 2.188-280 | 1.08 | 0.01 | 0.15 | 0.12 | 100.13 | 1.00 |
| 灵芝酸A Ganoderic acid A | Y=9.66e+ 003X- 2.39e+002 | 0.9996 | 1.953-250 | 1.00 | 0.16 | 0.96 | 0.25 | 101.46 | 1.58 |
| 灵芝酸H Ganoderic acid H | Y=5.86e+ 003X+ 1.95e+003 | 0.9996 | 3.203-410 | 1.65 | 0.37 | 1.55 | 2.48 | 102.72 | 1.38 |
| 赤芝酸A Lucidenic acid A | Y=5.12e+ 003X- 3.61e+002 | 0.9997 | 4.297-550 | 1.89 | 0.25 | 2.36 | 0.37 | 101.38 | 0.47 |
| 灵芝烯酸D Ganoderenic acid D | Y=2.18e+ 004X+ 3.19e+002 | 0.9996 | 0.859-110 | 0.44 | 0.28 | 0.10 | 0.36 | 99.93 | 1.03 |
| 灵芝酸D Ganoderic acid D | Y=1.03e+ 004X- 1.30e+003 | 0.9996 | 1.797-230 | 0.94 | 0.14 | 0.17 | 1.05 | 100.88 | 1.52 |
| 灵芝酸F Ganoderic acid F | Y=7.77e+ 003X- 2.33e+002 | 0.9997 | 2.343-300 | 1.24 | 0.10 | 1.21 | 0.58 | 99.17 | 1.91 |
注:待测组分相对校正因子=内参物灵芝酸A回归方程斜率/待测组分回归方程斜率
Note: Relative correction factor of the component to be tested=Slope of regression equation for reference material ganoderic acid A/Slope of the regression equation of the component to be tested.
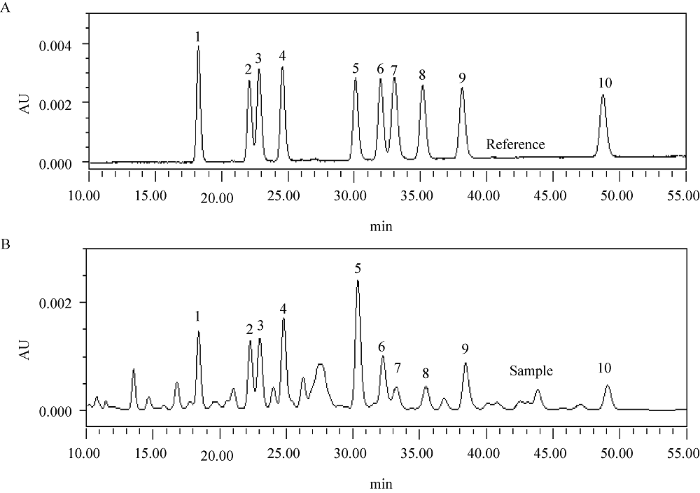
图2
图2
样品和对照品的HPLC图谱 A:标准品;B:样品. 1:灵芝酸C2;2:灵芝酸G;3:灵芝烯酸B;4:灵芝酸B;5:灵芝酸A;6:灵芝酸H;7:赤芝酸A;8:灵芝烯酸D;9:灵芝酸D;10:灵芝酸F
Fig. 2
HPLC chromatogram of tested samples and standard products. A: Standard; B: Sample. 1: Ganoderic acid C2; 2: Ganoderic acid G; 3: Ganoderenic acid B; 4: Ganoderic acid B; 5: Ganoderic acid A; 6: Ganoderic acid H; 7: Lucidenic acid A; 8: Ganoderenic acid D; 9: Ganoderic acid D; 10: Ganoderic acid F.
2.2.2 精密度试验
取1.2.2中同一混合标准溶液,连续进样7次,根据各三萜色谱峰面积的RSD考察仪器精密度(表1)。
2.2.3 重复性试验
取灵芝子实体水提物样品7份,每份0.5 g,精密称定,按1.2.3中的条件平行操作制备供试品溶液,分别进样测定,以各三萜含量测定结果的RSD为参考,考察方法的重复性(表1)。
2.2.4 稳定性试验
取灵芝子实体水提物样品溶液,按照2.1中优化得到的最终的色谱条件,分别于0、2、4、
6、8、12、24 h测定,以色谱峰面积的RSD考察方法在24h内的稳定性(表1)。
2.2.5 加样回收率试验
取同一含量已知的灵芝水提物样品7份,每份0.5 g,按1.2.3制备供试品溶液,分别加入一定量混合标准品溶液,按照2.1中优化得到的最终的色谱条件测定,计算平均回收率,并求出RSD (表1)。
2.3 灵芝子实体原料三萜含量测定及分析
表2 灵芝子实体中三萜类成分含量测定
Table 2
| 标准溶液 Standard samples | a1 | a2 | a3 | a4 | 均值 Average |
|---|---|---|---|---|---|
| 灵芝酸C2 Ganoderic acid C2 | 619.66 | 386.56 | 545.62 | 720.52 | 568.09 |
| 灵芝酸G Ganoderic acid G | 391.52 | 344.34 | 478.42 | 525.02 | 434.83 |
| 灵芝烯酸B Ganoderenic acid B | 198.20 | 79.42 | 125.70 | 124.04 | 131.84 |
| 灵芝酸B Ganoderic acid B | 447.08 | 369.00 | 491.02 | 658.88 | 491.50 |
| 灵芝酸A Ganoderic acid A | 624.68 | 764.62 | 1 032.40 | 1 275.00 | 924.18 |
| 灵芝酸H Ganoderic acid H | 310.50 | 497.16 | 722.98 | 763.56 | 573.55 |
| 赤芝酸A Lucidenic acid A | 234.96 | 435.10 | 551.92 | 664.76 | 471.69 |
| 灵芝烯酸D Ganoderenic acid D | 48.28 | 64.04 | 113.60 | 122.14 | 87.02 |
| 灵芝酸D Ganoderic acid D | 303.34 | 457.36 | 614.92 | 756.02 | 532.91 |
| 灵芝酸F Ganoderic acid F | 308.14 | 675.06 | 844.36 | 919.44 | 686.75 |
| 总计 Total | 3 486.36 | 4 072.66 | 5 520.94 | 6 529.38 | 4 902.34 |
2.4 灵芝水提物及灵芝产品中三萜含量测定及分析
灵芝子实体水提物样品结果见表3,经分析10种三萜的含量在2.52%-6.83%之间,较灵芝子实体原料大幅度提高,因此这类极性较大的灵芝三萜可以经过水提工艺得到有效的提取和富集。
表3 灵芝子实体水提物样品中三萜类成分含量测定
Table 3
| 标准溶液 Standard samples | b1 | b2 | b3 | b4 | 均值 Average |
|---|---|---|---|---|---|
| 灵芝酸C2 Ganoderic acid C2 | 975.93 | 1 306.48 | 6 782.45 | 7 342.77 | 4 101.91 |
| 灵芝酸G Ganoderic acid G | 2 250.05 | 2 699.10 | 8 313.86 | 9 313.46 | 5 644.12 |
| 灵芝烯酸B Ganoderenic acid B | 1 155.07 | 1 407.88 | 5 372.88 | 5 920.04 | 3 463.97 |
| 灵芝酸B Ganoderic acid B | 1 208.73 | 1 588.04 | 6 640.98 | 8 692.62 | 4 532.59 |
| 灵芝酸A Ganoderic acid A | 5 528.99 | 6 963.21 | 9 917.15 | 10 899.20 | 8 327.14 |
| 灵芝酸H Ganoderic acid H | 3 384.15 | 4 136.19 | 10 590.93 | 11 737.99 | 7 462.32 |
| 赤芝酸A Lucidenic acid A | 3 510.33 | 4 200.30 | 3 673.58 | 4 165.30 | 3 887.38 |
| 灵芝烯酸D Ganoderenic acid D | 1 521.46 | 1 821.83 | 2 333.30 | 2 657.03 | 2 083.41 |
| 灵芝酸D Ganoderic acid D | 2 581.44 | 3 242.97 | 3 944.27 | 4 491.23 | 3 564.98 |
| 灵芝酸F Ganoderic acid F | 3 078.23 | 3 564.21 | 2 577.87 | 3 042.87 | 3 065.80 |
| 总计 Total | 25 194.38 | 30 930.21 | 60 147.26 | 68 262.51 | 46 133.59 |
灵芝产品结果见表4。通过对4个市售的灵芝子实体水提物产品中10种三萜类成分含量的测定发现,产品中三萜含量为0.27%-0.84%。推测市售灵芝产品中三萜含量低于实验室制备灵芝水提物的原因可能与各产品的水提工艺及与产品中添加的辅料的量有关。
表4 灵芝子实体水提物产品中三萜类成分含量测定
Table 4
| 标准溶液 Standard samples | b1 | b2 | b3 | b4 | 均值 Average |
|---|---|---|---|---|---|
| 灵芝酸C2 Ganoderic acid C2 | 150.02 | 164.74 | 155.05 | 261.68 | 182.87 |
| 灵芝酸G Ganoderic acid G | 382.88 | 477.01 | 530.56 | 678.72 | 517.29 |
| 灵芝烯酸B Ganoderenic acid B | 52.36 | 213.42 | 193.06 | 333.72 | 198.14 |
| 灵芝酸B Ganoderic acid B | 246.20 | 180.03 | 238.49 | 333.20 | 249.48 |
| 灵芝酸A Ganoderic acid A | 388.49 | 830.58 | 1 364.02 | 2 074.80 | 1 164.47 |
| 灵芝酸H Ganoderic acid H | 528.41 | 802.30 | 770.42 | 927.16 | 757.07 |
| 赤芝酸A Lucidenic acid A | 405.08 | 622.36 | 835.78 | 1 369.76 | 808.25 |
| 灵芝烯酸D Ganoderenic acid D | 50.22 | 243.68 | 396.38 | 673.53 | 340.95 |
| 灵芝酸D Ganoderic acid D | 218.03 | 360.48 | 644.54 | 973.64 | 549.17 |
| 灵芝酸F Ganoderic acid F | 318.66 | 501.86 | 809.19 | 818.22 | 611.98 |
| 总计 Total | 2 740.35 | 4 396.46 | 5 937.49 | 8 444.43 | 5 379.68 |
3 讨论
高效液相法在灵芝三萜含量测定中的应用越来越多,可以更准确地分析灵芝子实体中三萜的种类和含量。本研究在灵芝子实体中三萜测定HPLC方法的基础上,通过筛选色谱柱,进一步优化色谱条件,最终确定了适用于灵芝水提物及其相关产品中三萜类成分的HPLC方法,且方法中灵芝酸A和灵芝H达到基线分离,该方法精密度高、重复性和稳定性好,可靠性强,可用于灵芝子实体水提物及其相关产品中10种三萜类成分的定量测定。
灵芝三萜是灵芝药材及相关产品质量控制的定量检测指标之一,以灵芝子实体为原料药品的提取工艺主要是热水提取,准确测定灵芝水提物中主要三萜类成分含量对灵芝药用产品质量控制十分重要。本研究对比分析灵芝子实体原料、灵芝水提物、灵芝产品中的三萜含量及组成,其中检测的10个三萜的峰面积达70%以上,能更好地表征不同灵芝产品中的三萜含量。
灵芝子实体中的三萜类成分种类繁多,极性相近,分离纯化的难度大且价格昂贵,为解决目前三萜标准品紧缺的问题,近年来灵芝三萜HPLC一测多评方法的研究备受关注,但是研究报道中各三萜的相对校正因子差异很大,使得一测多评方法的推广应用受限。本研究发现不同公司购买灵芝三萜纯度相差较大,因此首先对购买得到的三萜进行纯度检测,并对不纯的灵芝三萜进一步纯化后再进行对照品的配制,保证了所用三萜标准品的纯度,使测定结果更加准确可靠。其中灵芝酸A为中国食品药品监督研究院国家药品标准物质,以灵芝酸A为对照品,计算其余9种三萜的相对校正因子,与美国药典中的数据基本一致,本研究计算的相对校正因子可为灵芝三萜HPLC一测多评法的推广应用提供参考。
参考文献
Species clarification of the prize medicinal Ganoderma mushroom “Lingzhi”
Antitumour, antimicrobial, antioxidant and antiacetylcholinesterase effect of Ganoderma lucidum terpenoids and polysaccharides: a review
Notes on the nomenclature of the most widely cultivated Ganoderma species in China
A comparison of the effectiveness of different treatments in extracting bioactive ingredients from Ganoderma lingzhi
Production of triterpenoids from Ganoderma lucidum: elicitation strategy and signal transduction
The progress of pharmacology on Ganoderma triterpene
Determination of triterpenoids in Ganoderma lingzhi from different areas and species by HPLC
Study on specific HPLC chromatogram of triterpenoids in extraction of Ganoderma lucidum alcohol
Determination of nine triterpenoid acids from Ganoderma lucidum of different producting areas by HPLC
Review of the molecular mechanisms of Ganoderma lucidum triterpenoids: ganoderic acids A, C2, D, F, DM, X and Y
One single standard substance for the simultaneous determination of 17 triterpenes in Ganoderma lingzhi and its related species using high-performance liquid chromatography
An assessment of the taxonomy and chemotaxonomy of Ganoderma
Anti-HIV-1 protease activity of lanostane triterpenes from the vietnamese mushroom Ganoderma colossum
Ganoderic acid Df, a new triterpenoid with aldose reductase activity from the fruiting body of Ganoderma lucidum
Quantitative determination of six major triterpenoids in Ganoderma lucidum and related species by high performance liquid chromatography
Analysis of Ganoderma by HPLC-QTOF MS
Resource diversity of Chinese macrofungi: edible, medicinal and poisonous species
Determination of triterpenoids in Ganoderma lingzhi spore powder by HPLC
Difference of chemical components in fruiting body, mycelium and spore powder of Ganoderma lingzhi
Simultaneous HPLC determination of four triterpenoid acids in Ganoderma lucidum
高效液相色谱法测定不同产地及品种灵芝三萜类成分的含量