灵芝Ganoderma lingzhi Sheng H. Wu, Y. Cao & Y.C. Dai隶属于担子菌门Basidiomycota、伞菌纲Agaricomycetes、多孔菌目Polyporales、多孔菌科Polyporaceae、灵芝属Ganoderma P. Karst (戴玉成等 2013),是被列入药食同源目录的中药材之一,具有安神、补气和增智等功效。
三萜是灵芝的重要活性成分之一,具有抗炎、抗肿瘤、抗病毒、保护肝脏和免疫调节等方面的作用(Gao et al. 2003;Feng et al. 2013;Jiao et al. 2016;Zolj et al. 2018;Peng et al. 2019)。因此三萜的含量是评价灵芝及其产品质量的重要指标之一。目前关于灵芝及其产品中三萜含量的测定主要参考药典方法和农业农村部的标准。药典方法至今仍为分光光度法:以齐墩果酸或熊果酸为对照品,5%香草醛-冰醋酸溶液和高氯酸为显色剂,通过分光光度计对样品进行测定(国家药典委员会 2020)。2013年农业农村部开始推行高效液相色谱法(high performance liquid chromatography,HPLC),此方法可以测定灵芝酸A和B的含量[农业部食用菌产品质量监督检验测试中心(上海)和上海市农业科学院农产品质量标准与检测技术研究所 2013]。由于灵芝三萜化合物制备困难、价格昂贵,使用高效液相法测定灵芝三萜的方法至今未被广泛推广,目前各质检机构在检测灵芝原料和相关产品时使用的仍然是分光光度法。
1 材料与方法
1.1 仪器和试剂
NL TRA超纯水仪(ELGA Lab Water公司),超高效液相色谱仪(Agilent LC1290 infinity II,安捷伦公司),超声波清洗器(KQ2200E,昆山市超声仪器有限公司),电子天平(FA2004A,上海精密科学仪器有限公司),酶标仪(Synergy HT96,Bio-Tik公司)。
齐墩果酸和脂肪酸等对照品购自Sigma公司,部分菌丝体中三萜对照品为实验室自制,其余三萜和甾醇对照品购自国家标准物质中心,纯度均≥98%。蒸馏水(实验室自制),香兰素、冰醋酸、高氯酸和乙酸乙酯(分析纯,国药集团药业股份有限公司)。灵芝子实体、菌丝体和孢子均来自沪农1号灵芝品种,其中,子实体和孢子材料由浙江龙泉基地提供,发酵菌丝体分为上层菌皮与下层菌球,其获取方式同骆军鑫等(2014)的报道。
1.2 超高效液相色谱分析样品中的三萜
取沪农1号灵芝子实体、菌皮、菌球和孢子材料,各精确称量1.5 g,加入无水乙醇30 mL,超声提取60 min,过0.2 μm滤膜后,上样测定。
色谱分析方法:选用Agilent Eclipse Plus C18色谱柱,1.8 μm,2.1 mm×150 mm。检测波长:254 nm。柱温:35 ℃。上样量:2 μL。流速:0.4 mL/min。流动相:0.01%醋酸水溶液(A)-乙腈(B)。洗脱程序:0 min,74% A,26% B;18 min,73% A,27% B;28 min,65% A,35% B;31 min,40% A,60% B;36 min,10% A,90% B;40 min,0% A,100% B;44 min,74% A,26% B。
1.3 分光光度法测定样品中的三萜
参照中华人民共和国药典(2020版)对样品进行分光光度法测定(国家药典委员会 2020)。
1.3.1 对照品和供试品溶液的制备
齐墩果酸对照品溶液的制备:取齐墩果酸对照品精密称定,加甲醇制成200 μg/mL溶液。
三萜、甾醇和脂肪酸对照品溶液的制备:将各化合物对照品精密称定,加甲醇制成1 mg/mL溶液。
灵芝生物样品的提取:精确称量沪农1号灵芝子实体、发酵的菌皮和菌球、孢子各样品1.5 g置具塞锥形瓶中,加乙醇30 mL,超声处理60 min,过滤,得上清液。
1.3.2 标准曲线的制备
精密量取齐墩果酸对照品溶液0.l、0.2、0.3、0.4和0.5 mL,分别置15 mL具塞试管中,挥干,放冷,精密加入新配制的香草醛冰醋酸溶液(精密称取香草醛0.5 g,加冰醋酸使溶解成10 mL) 0.2 mL、高氯酸0.8 mL,摇匀,在70 ℃水浴中加热15 min,立即置冰浴中冷却5 min,取出,精密加入乙酸乙酯4 mL,摇匀,以相应试剂为空白,按照紫外-可见分光光度法,在546 nm波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线。
1.3.3 化合物的分光光度法测定
各取40 μL的化合物溶液置15 mL具塞试管中,按1.3.2的步骤,自“挥干”起,同法操作,测定吸光度并根据标准曲线计算含量。
1.3.4 灵芝生物样品的分光光度法测定
精密量取各灵芝生物样品提取液0.2 mL,分别置15 mL具塞试管中,按1.3.2的步骤,自“挥干”起,同法操作,测定吸光度,根据标准曲线计算生物样品中三萜含量。
2 结果与分析
2.1 超高效液相法对灵芝子实体、菌丝体(菌皮、菌球)和孢子的分析
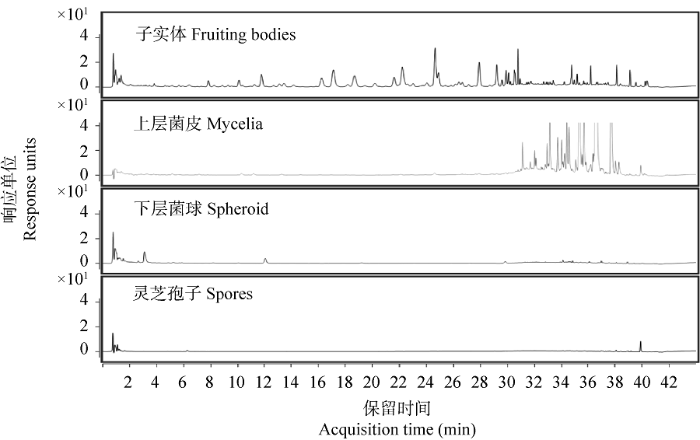
实验在三萜化合物较为适合的紫外吸收波长254 nm下进行检测,因此色谱图中可以观察到灵芝生物样品中大部分的三萜化合物(图1),灵芝子实体中的三萜种类最多,菌皮中的三萜种类较少但单个三萜化合物含量较高,而菌球和孢子在同等提取和前处理条件下,几乎检测不到三萜的存在。甾醇类化合物是灵芝子实体、菌丝体和孢子中均广泛存在的一类物质(Lin & Yang 2019),但由于甾醇类化合物结构复杂多样,此类化合物的紫外吸收没有统一的波段,有的化合物甚至没有紫外吸收。而灵芝中饱和和不共轭的脂肪酸类化合物也没有紫外吸收,因此,在254 nm波段下,灵芝子实体、菌丝体和孢子中的大部分甾醇和脂肪酸化合物不能被检测到。
图1
图1
四种生物样品的超高效液相色图谱
Fig. 1
UPLC chromatogram of four samples of Ganoderma lingzhi.
2.2 分光光度法对灵芝子实体、菌丝体(上层菌皮)、菌球和孢子中三萜含量的测定
分光光度法测定结果与液相色谱检测所观察到的现象并不一致,分光光度法测定的结果(表1)中,灵芝发酵获得的上层菌皮里的三萜含量最高,孢子次之,子实体较低,菌球中的三萜含量最低。此结果证明了采用分光光度法来测定灵芝中的三萜含量是不准确的。为探讨这一现象发生的原因,接着将灵芝子实体、菌丝体和孢子中报道的含量较高的三萜、甾醇和脂肪酸三类化合物逐一进行了分光光度法的测定。
表1 四种样品分光光度法测定结果
Table 1
| 样品 Samples | 子实体 Fruiting bodies | 菌皮 Mycelia | 菌球 Spheroid | 孢子 Spores |
|---|---|---|---|---|
| 总三萜含量 Total content of triterpenes (%) | 1.28±0.07 | 4.10±0.10 | 0.84±0.07 | 3.56±0.06 |
2.3 受试化合物分光光度法检测
实验中,所有受试化合物的实际值均为40 μg。分光光度法测定这些化合物的结果见表2、表3、表4和表5,除了lanosta-7,9(11),24-trien-3α-hydroxy-26-oic acid这个三萜化合物的测定值超过实际值,达到了41.91 μg,其余所有化合物的测定值均小于实际值。对于三萜类化合物来说,菌丝体中的灵芝酸类化合物(含有1对共轭双键和1个支链末端双键)与中性三萜化合物(灵芝酮、醛、醇、内酯等无末端羧基的化合物)的测定值比大部分的其他结构类别的灵芝三萜类化合物要高。比如ganoderic acid P、ganoderic acid TR、ganoderic acid R、ganoderic acid S、lanosta-7,9(11),24-trien-3α-hydroxy-26-oic acid、ganoderone A、lucidal、ganodermanontriol、lucialdehyde A、ganoderol A、ganoderiol F和ganoderol B的测定值都能超过20 μg。被检测的所有类型三萜化合物中,均有测定值小于10 μg的化合物。但值得注意的是,结构中无共轭双键的灵芝酸类和灵芝烯酸类化合物,是灵芝子实体中含量较高的一类三萜化合物,也是被众多研究者们重点进行分析检测的研究对象,这类化合物在分光光度法测定中的响应最弱,大部分的测定值都低于20 μg,其中,ganoderic acid A的测定值仅为6.73 μg,是所有化合物中的最低值。
表2 灵芝酸类化合物的特征性官能团和测定值
Table 2
| 种类 Types | 化合物 Compounds | C3位官能团 Functional group on C3 | 双键位置 Position of double bond | 测定值 Measured value (μg) |
|---|---|---|---|---|
| 灵芝烯酸 Ganoderenic acids | Ganoderenic acid B | 3β-OH | 8-9, 20-22 | 8.52±0.15 |
| Ganoderenic acid D | 3=O | 8-9, 20-22 | 8.72±0.09 | |
| Ganoderenic acid C | 3β-OH | 8-9, 20-22 | 11.11±0.23 | |
| Ganoderenic acid F | 3=O | 8-9, 20-22 | 13.74±0.17 | |
| Ganoderenic acid A | 3=O | 8-9, 20-22 | 14.29±0.09 | |
| Ganoderenic acid E | 3=O | 8-9, 20-22 | 14.99±0.31 | |
| 灵芝酸 (含有共轭双键) Ganoderic acids (Conjugated double bonds) | Ganoderic acid TQ | 3=O | 7-8(9-11), 24-25 | 8.86±0.10 |
| Ganoderic acid SZ | 3=O | 7-8(9-11), 24-25 | 9.77±0.23 | |
| Ganoderic acid Jb | 3β-OH | 7-8(9-11), 24-25 | 10.36±0.23 | |
| Ganoderic acid TN | 3β-OH | 7-8(9-11), 24-25 | 13.79±0.23 | |
| Ganoderic acid Y | 3β-OH | 7-8(9-11), 24-25 | 16.18±0.23 | |
| Ganoderic acid T1* | 3α-OAc | 7-8(9-11), 24-25 | 18.47±0.09 | |
| Ganoderic acid T* | 3α-OAc | 7-8(9-11), 24-25 | 18.47±0.09 | |
| Ganoderic acid Mk* | 3α-OH | 7-8(9-11), 24-25 | 18.87±0.09 | |
| Ganoderic acid Me* | 3α-OAc | 7-8(9-11), 24-25 | 19.42±0.15 | |
| Ganoderic acid P* | 3α-OH | 7-8(9-11), 24-25 | 20.49±0.29 | |
| Ganoderic acid TR | 3=O | 7-8(9-11), 24-25 | 22.10±0.15 | |
| Ganoderic acid R* | 3α-OAc | 7-8(9-11), 24-25 | 22.20±0.09 | |
| Ganoderic acid S* | 3α-OH | 7-8(9-11), 24-25 | 24.14±0.09 | |
| Lanosta-7,9(11),24-trien-3α-hydroxy-26-oic acid* | 3α-OH | 7-8(9-11), 24-25 | 41.91±0.09 | |
| 灵芝酸 (不含共轭双键) Ganoderic acids (No conjugated double bonds) | Ganoderic acid A | 3=O | 8-9 | 6.73±0.15 |
| Ganoderic acid LM2 | 3=O | 8-9, 24-25 | 7.63±0.15 | |
| Ganoderic acid N | 3=O | 8-9 | 7.78±0.15 | |
| Ganoderic acid C6 | 3β-OH | 8-9 | 8.03±0.17 | |
| Ganoderic acid F | 3=O | 8-9 | 8.72±0.23 | |
| Ganoderic acid K | 3β-OH | 8-9 | 9.02±0.23 | |
| Ganoderic acid G | 3β-OH | 8-9 | 9.57±0.15 | |
| Ganoderic acid B | 3β-OH | 8-9 | 9.67±0.17 | |
| Ganoderic acid H | 3β-OH | 8-9 | 10.06±0.05 | |
| Ganoderic acid I | 3β-OH | 8-9 | 10.91±0.15 | |
| Ganoderic acid C2 | 3β-OH | 8-9 | 11.01±0.09 | |
| Ganoderic acid L | 3β-OH | 8-9 | 11.21±0.15 | |
| 12-Hydroxy-ganoderic acid D | 3=O | 8-9 | 11.21±0.20 | |
| Ganoderic acid DM | 3=O | 8-9, 24-25 | 12.35±0.31 | |
| 20-Hydroxyganoderic acid G | 3β-OH | 8-9 | 12.75±0.23 | |
| Ganoderic acid D | 3=O | 8-9 | 13.50±0.09 | |
| 7-Oxo-ganoderic acid Z | 3β-OH | 8-9, 24-25 | 16.38±0.09 | |
| 23S-hydroxy-11,15-dioxo-ganoderic acid DM | 3β-OH | 8-9, 24-25 | 19.32±0.09 | |
| Ganoderic acid AM1 | 3β-OH | 8-9 | 22.05±0.08 | |
| Ganoderic acid Z | 3β-OH | 8-9, 24-25 | 26.28±0.75 |
注:标“*”的化合物均为本实验室从灵芝菌丝体中制备得到. 下同
Note: Compounds marked with “*” were isolated from mycelia of Ganoderma lingzhi in our laboratory. The same below.
表3 灵芝酮、醛、醇、内酯类化合物的特征性官能团和测定值
Table 3
| 化合物 Compounds | C3位官能团 Functional group on C3 | 双键位置 Position of double bond | 测定值 Measured value (μg) |
|---|---|---|---|
| Ganoderiol A | 3β-OH | 7-8(9-11) | 7.23±0.23 |
| Ethyl ganoderate J | 3=O | 8-9 | 10.36±0.23 |
| 3β,7β,15β-Trihydroxy-11-oxo-lanosta-8-en-24->20 lactone | 3β-OH | 8-9 | 11.76±0.31 |
| Ganoderlactone D | 3β-OH | 8-9 | 12.30±0.23 |
| Ganolactone B | 3β-OH | 8-9 | 13.05±0.23 |
| Lucialdehyde B | 3=O | 8-9, 24-25 | 13.65±0.38 |
| Ganoderal A | 3=O | 7-8(9-11), 24-25 | 15.59±0.09 |
| Ganodermanondiol* | 3=O | 7-8(9-11) | 19.52±0.09 |
| Ganoderone A | 3β-OH | 8-9, 24-25 | 21.46±0.31 |
| Lucidal | 3β-OH | 8-9, 24-25 | 27.08±0.09 |
| Ganodermanontriol* | 3=O | 7-8(9-11) | 27.28±0.09 |
| Lucialdehyde A | 3β-OH | 7-8(9-11), 24-25 | 30.31±0.26 |
| Ganoderol A | 3=O | 7-8(9-11), 24-25 | 31.26±0.31 |
| Ganoderiol F | 3=O | 7-8(9-11), 24-25 | 38.27±0.70 |
| Ganoderol B* | 3β-OH | 7-8(9-11), 24-25 | 39.76±0.53 |
表4 甾醇类化合物的特征性官能团和测定值
Table 4
| 化合物 Compounds | C3位官能团 Functional group on C3 | 双键位置 Position of double bond | 测定值 Measured value (μg) |
|---|---|---|---|
| Ergosta-4,6,8(14),22-tetraen-3-one | 3=O | 4-5(6-7)(8-14), 22-23 | 7.71±0.17 |
| β-Sitosterol | 3β-OH | 5-6 | 8.31±0.09 |
| Cerevisterol | 3β-OH | 7-8, 22-23 | 16.04±0.10 |
| Ergosterol peroxide | 3β-OH | 6-7, 22-23 | 20.45±0.12 |
| 3,5-Dihydroxyergosta-7,22-dien-6-one | 3β-OH | 7-8, 22-23 | 21.50±0.17 |
| Ergosterol | 3β-OH | 5-6(7-8)22-23 | 21.79±0.10 |
| 3,5,9-Trihydroxyergosta-7,22-dien-6-one | 3β-OH | 7-8, 22-23 | 22.59±0.10 |
| 5,8-Epidioxyergosta6,9(11),22-trien-3-ol | 3β-OH | 6-7, 9-11, 22-23 | 22.71±0.03 |
| 6-O-Methylcerevisterol | 3β-OH | 7-8, 22-23 | 31.04±0.10 |
| Stellasterol | 3β-OH | 7-8, 22-23 | 33.51±0.40 |
表5 脂肪酸类化合物的特征性官能团和测定值
Table 5
| 化合物 Compounds | 双键位置 Position of double bond | 测定值 Measured value (μg) |
|---|---|---|
| Stearic acid | 7.94±0.26 | |
| Nonadecanoic acid | 7.88±0.17 | |
| Palmitic acid | 8.63±0.26 | |
| Behenic acid | 9.49±0.26 | |
| Benzoic acid | 10.06±0.20 | |
| Linoleic acid | 6-7, 9-10 | 25.29±0.79 |
| Oleic acid | 9-10 | 25.75±0.70 |
除三萜化合物外,实验中所有的甾醇和脂肪酸化合物也都会在香草醛-冰醋酸-高氯酸体系下发生显色反应,在546 nm处存在可见光吸收。其中甾醇类化合物的测定值多数都能达到20 μg以上,而6-O-methylcerevisterol和stellasterol两个化合物的测定值更是超过30 μg,比多数的三萜类化合物都要高。脂肪酸类的化合物中linoleic acid和oleic acid的测定值要显著高于其他脂肪酸类化合物。这表明分光光度法测定灵芝三萜含量时不但不能准确反映三萜的含量,还会受到灵芝中甾醇、脂肪酸类化合物的干扰。
2.4 受试化合物结构对分光光度法测定结果的影响
分光光度法测定三萜化合物含量的具体作用原理仍不清楚。比较公认的说法是:三萜在无水条件下与强酸、中等强酸或路易斯酸作用,使得结构上的羟基脱水,增加双键结构,再经双键移位、双分子缩合等反应生成共轭双烯系统,又在酸作用下形成阳碳离子而呈色。因此,全饱和的、C3位无羟基或羰基的化合物呈阴性反应。本来就有共轭双键的化合物显色很快,只有孤立双键的化合物显色较慢(裴月湖等 2016)。
本研究为探讨灵芝中三萜、甾醇和脂肪酸与检测试剂是否发生反应及显色程度的规律,专门总结了受试化合物中C3位官能团的取代情况和双键的个数和位置与测定值的关系。三萜化合物,根据其双键特征可分为灵芝酸(1个双键)、灵芝烯酸(2个双键)、菌丝体灵芝酸(1对共轭双键和1个支链末端双键)和灵芝酮、醛、醇等中性三萜4种类型。其中,菌丝体灵芝酸和部分灵芝酮、醛、醇类中性三萜的测定值普遍较高,推测与其结构自身就有共轭双键有关(但ganoderiol A是例外)。
从实验结果可以看出,C3上的取代和主链羟基的位置在三萜化合物的显色方面有着重要作用。一方面当化合物的结构在主链上除了C3位没有其他羟基取代时,C3位连接有羟基的化合物要比C3位连接有酮基的化合物显色能力更强。这一结论可以从化合物lucialdehyde B和lucidal、ganoderal A和lucialdehyde A、ganoderol A和ganoderol B、ganoderic acid TQ和ganoderic acid TN、ganoderic acid SZ和ganoderic acid Y之间的结构与测定值的比较得出。另一方面,从另一类化合物如ganoderenic acid C和ganoderenic acid A、ganoderenic acid D和ganoderenic acid F、ganoderic acid Jb和ganoderic acid TR之间的对比可以看出,当化合物在主链上还有更多的羟基取代时,C3上是酮基取代的化合物要比C3位是羟基取代的化合物显色能力更强。值得注意的是,在菌丝体灵芝酸中,C3位的羟基取代为α构型时,相较于β构型,其测定值普遍偏高;C3位为乙酰氧基取代时,菌丝体中的三萜化合物也具有较高的测定值。
而在甾醇类化合物中,C3位的羟基对化合物的显色必不可少,C3位没有羟基取代的化合物ergosta-4,6,8(14),22-tetraen-3-one的测定值最低。脂肪酸类化合物中,双键对其显色至关重要,没有双键的几种饱和脂肪酸:stearic acid、nonadecanoic acid、palmitic acid、behenic acid和benzoic acid的测定值较低,这与Knight et al. (1972)的研究结果相符。
3 讨论
灵芝在不同生长时期,其三萜的含量与种类有很大不同。在菌丝体时期,灵芝酸S、灵芝酸T和灵芝酸Mk等60多种特有的灵芝酸和少数几种灵芝醇生成于静置发酵产生的上层菌皮表层的分生孢子中,而下层的菌球中三萜含量较低(Fang & Zhong 2002)。灵芝子实体形成后,其中的三萜化合物更加丰富。据报道,灵芝子实体中的三萜有160余种,按照结构的不同可以分为灵芝酸、烯酸、酮、醛、醇和内酯等多种类型(Lin & Yang 2019)。灵芝孢子中的三萜种类则最少,目前仅有30余种化合物被报道(Ma et al. 2011;Lin & Yang 2019)。甾醇、脂肪酸则是灵芝不同生长阶段都共有的化学成分(Lin & Yang 2019)。
根据现有的研究,灵芝子实体中含量较高的三萜为ganoderic acid A、ganoderic acid B、ganoderic acid C2、ganoderic acid D、ganoderic acid H、ganoderic acid G、ganoderenic acid A、ganoderenic acid B和ganoderenic acid D等灵芝酸、灵芝烯酸类化合物(Da et al. 2012;李保明等 2012)。但这些含量较高的灵芝酸和灵芝烯酸类化合物在香草醛-冰醋酸-高氯酸显色体系下的显色效果均较差,其测定值与实际值比较,这类化合物的总体含量被低估了75%左右。推测这是造成分光光度法检测时灵芝子实体中三萜测定值要比菌丝体和孢子粉偏低的主要原因。
本研究表明分光光度法并不适用于测定灵芝及其产品中三萜的总含量。灵芝中甾醇、脂肪酸的存在均会成为分光光度法测定结果的干扰因素,影响测定的准确性,尤其是当测试对象为灵芝孢子时,结果会呈现出非常明显的假阳性。齐墩果酸不适用于作为化学法测定灵芝三萜的标准品,其作为标准品会造成灵芝三萜含量的测定值远小于实际值。随着制备技术的进步和分析仪器的普及,建议在相关的政策法规中,用更加精确全面的高效液相色谱法逐渐取代无专属检验能力的分光光度法。
参考文献
Comparison of two officinal Chinese pharmacopoeia species of Ganoderma based on chemical research with multiple technologies and chemometrica ananlysis
DOI:10.1016/j.chroma.2011.12.017 URL [本文引用: 1]
Notes on the nomenclature of the most widely cultivated Ganoderma species in China
Two-stage culture process for improved production of ganoderic acid by liquid fermentation of higher fungus Ganoderma lucidum
DOI:10.1021/bp010136g URL [本文引用: 1]
Anti-lung cancer activity through enhancement of immunomodulation and induction of cell apoptosis of total triterpenes extracted from Ganoderma lucidum (Leyss. ex Fr.) Karst
DOI:10.3390/molecules18089966 URL [本文引用: 1]
Antibacterial and antiviral value of the genus Ganoderma P. Karst. species (Aphyllophoromycetideae): a review
Study on the extraction of triterpenes and sterols from Ganoderma lucidum by supercritical CO2 under high pressure
Lanostane triterpenoids from Ganoderma curtisii and their NO production inhibitory activities of LPS-induced microglia
DOI:10.1016/j.bmcl.2016.06.023 URL [本文引用: 1]
Chemical basis of the sulfophospho-vanillin reaction for estimating total serum lipid
Determination of nine triterpenoid acids from Ganoderma lucidum of different producting areas by HPLC
Ganoderma and health: biology, chemistry and industry
Ganoderma spore powder contains little triterpenoids
DOI:10.1186/s13020-020-00391-1 URL [本文引用: 1]
Influences of culture methods on the yield and antineoplastic activity of intracellular triterpene of Ganoderma lucidum mycelia
Triterpenoids from the spores of Ganoderma lucidum
Extraction and fatty acid compositions analysis of spore oil from Ganoderma lucidum
DOI:10.1111/j.1365-2621.1969.tb14358.x URL
Determination of ganoderic acid in ganoderma products by HPLC
Lanostane-type triterpenoids from the fruiting bodies of Ganoderma applanatum
DOI:10.1016/j.phytochem.2018.10.011 URL [本文引用: 1]
Production of individual ganoderic acids and identification of differentially expressed genes in liquid static and shaking cultures of Ganoderma lucidum
Determination of triterpenoids in Ganoderma lingzhi spore powder by HPLC
Determination of liposoluble components in Ganoderma lingzhi spore powder
Active components in mycelia of sporeless Ganoderma lingzhi
Discussion on the determination of total triterpenes in Ganoderma lucidum by spectrophotometry
Antiproliferative effects of a triterpene-enriched extract from lingzhi or reishi medicinal mushroom, Ganoderma lucidum (agaricomycetes), on human lung cancer cells
DOI:10.1615/IntJMedMushrooms.2018028823 URL [本文引用: 1]
灵芝产品中灵芝酸含量的测定高效液相色谱法
灵芝孢子粉中脂溶性成分分析方法的建立